Содержание
- 2. ОСНОВНЫЕ ГРУППЫ ЗАБОЛЕВАНИЯ Заболевания желудка (острые и хронические гастриты, язвенная болезнь желудка) Заболевания кишечника (острый энтероколит,
- 3. ОСНОВНЫЕ КЛИНИЧЕСКИЕ СИНДРОМЫ
- 4. МЕТОДЫ ИССЛЕДОВАНИЯ
- 5. ДИАГНОСТИКА ЗАБОЛЕВАНИЙ ПЕЧЕНИ И ЖЕЛЧНЫХ ПУТЕЙ ИССЛЕДОВАНИЕ ФЕРМЕНТОВ ПЕЧЕНИ Аминотрансферазы – ферменты, катализирующие взаимное превращение аминокислот
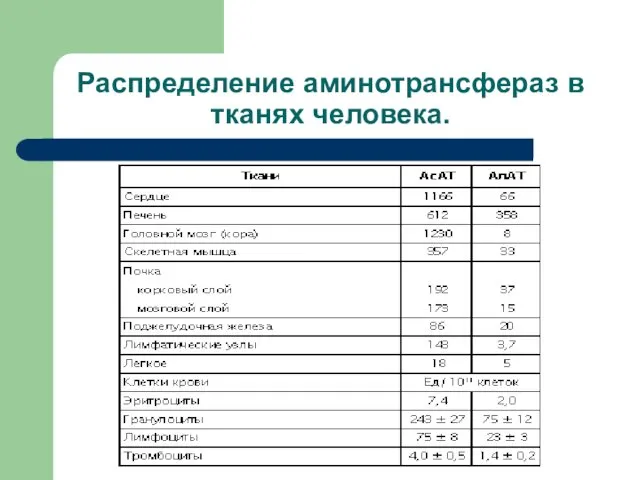
- 6. Распределение аминотрансфераз в тканях человека.
- 7. ИЗМЕНЕНИЕ АКТИВНОСТИ АМИНОТРАНСФЕРАЗ ПРИ ГЕПАТИТАХ
- 8. Методы определения активности аминотрансфераз. Методы с фиксированным временем инкубации (end point). Основаны на способности кетокислот вступать
- 9. Методы непрерывной регистрации (kinetic). Контроль над скоростью реакции переаминирования можно осуществлять сочетанием аминотрансферазной реакции с реакцией,
- 10. БИЛИРУБИН Билирубин - оранжево-желтый пигмент, образующийся, в основном, при разрушении стареющих эритроцитов. В 1849 г. и
- 11. Токсический эффект на клетки избытка билирубина. При избытке содержания билирубина в крови он становится основным повреждающим
- 12. ФАКТОРЫ ОКАЗЫВАЮЩИЕ ВЛИЯНИЕ НА КОНЦЕНТРАЦИЮ БИЛИРУБИНА В КРОВИ прием пищи (концентрация билирубина после 48-часового голодания может
- 13. Методы определения билирубина. Реакция между билирубином и диазотированной сульфаниловой кислотой, открытая Эрлихом в 1883 г., была
- 14. Ферментативные методы. Данная группа методов определения билирубина базируется на реакции окислении билирубина билирубиноксидазой (КФ 1.3.35) до
- 15. Неинвазивный метод определения билирубина. Были разработаны неинвазивные методы для чрескожного определения билирубина с помощью билирубинометров. Билирубинометр
- 16. Технология «сухой» химии. Разработаны два подхода с использованием технологии сухой химии в виде тест-полосок. Для определения
- 17. Хроматографический метод. Использование высокоэффективной жидкостной хроматографии (ВЭЖХ) позволяет преодолеть многие проблемы, связанные с нестабильностью билирубина и
- 18. Исследуемый материал. Для определения концентрации общего билирубина методами, основанными на реакции диазосочетания, используют сыворотку или плазму.
- 19. Стандартизация методов. Существенной проблемой стандартизации является выбор надлежащего калибровочного материала. Наличие очевидных погрешностей и различий в
- 20. Погрешности. Гемолиз может или завышать, или занижать результаты определения концентрации билирубина. Направленность эффекта зависит как от
- 21. Щелочная фосфотаза Термином «щелочная фосфатаза» (ЩФ) — фосфогидролаза моноэфиров ортофосфорной кислоты (КФ 3.1.3.1) — обозначают группу
- 22. Методы определения общей активности щелочной фосфатазы Представителем классического подхода к определению активности ЩФ является метод, предложенный
- 23. Методы определения общей активности щелочной фосфатазы A Togari и соавт. определяли образующийся в реакции фенол с
- 24. Методы определения общей активности щелочной фосфатазы Наиболее популярным для определения ЩФ субстратом оказался хромогенный, так называемый
- 25. Гамма-глутамилтранспептидаза преимущественно мембраносвязанный гликопротеин, катализирующий перенос аминокислот через клеточную мембрану, регулирующий разрушение и конъюгацию глутатиона, а
- 26. Методы определения активности ГГТП Первым субстратом, примененным для определения активности гамма-глутамилтранспептидазы, был глутатион. Предложенные затем иные
- 27. Методы определения активности ГГТП В1963 предложили использовать в качестве субстрата гамма-глутамил-4-нитроанилид, применили его в разработанном им
- 28. Методы определения активности ГГТП Процедура выполнения методики еще более упростилась в связи с применением хромогенного субстрата
- 29. Методы определения активности ГГТП Известен флюориметрический метод определения активности ГГТП. По сравнению со спектрофотометрическим он обладает
- 30. Значение определения активности гамма-глутамилтранспептидазы в сыворотке крови Определение активности гамма-глутамилтрансферазы в сыворотке (плазме) крови приобрело большое
- 31. Значение определения активности гамма-глутамилтранспептидазы в сыворотке крови У больных злокачественными опухолями без метастазов в печень лишь
- 32. Значение определения активности гамма-глутамилтранспептидазы в сыворотке крови Желтуха всегда сопровождается увеличением активности ГГТП, высокая активность ГГТП
- 33. ДИАГНОСТИКА ЗАБОЛЕВАНИЯ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Амилаза - кальцийзависимый фермент, ионы кальция абсолютно необходимы для проявления функциональной активности.
- 34. АМИЛАЗА Активность амилазы в крови обычно низкая и резко возрастает при остром панкреатите и сиалоадените (бактериальная
- 35. Методы определения активности амилазы. Амилокластические методы. Трудности при использовании крахмала в качестве субстрата связаны с тем,
- 36. Методы определения активности амилазы. Турбидиметрические и нефелометрические методы- основаны на способности амилазы снижать мутность суспензии субстрата
- 37. Методы определения активности амилазы. Вискозиметрические методы. Основаны на изменении вязкости инкубационной среды в ходе гидролиза крахмала
- 38. Выбор метода определения активности амилазы Использовать субстрат с известной структурой, качеством, разумной стоимостью и известными продуктами
- 39. Перспективные методы лабораторной диагностики острого панкреатита Определение эластазы в сыворотке крови, кале. Определение колипазы в сыворотке
- 40. Лабораторные показатели крови при остром панкреатите Изменения лабораторных показателей при разных формах ОП и в зависимости
- 41. Лабораторные показатели крови при остром панкреатите Активность а-амилазы сыворотки является важным показателем для острого панкреатита, повышение
- 42. ЭЛАСТАЗА Эластаза является протеолитическим ферментом. Она имеет сродство к пептидным участкам, содержащим аланин, валин и лейцин,
- 43. ЭЛАСТАЗА Копрологическое тестирование. В отличие от других энзимов, экскретируемых поджелудочной железой, эластаза в процессе пассажа по
- 44. МЕТОДЫ ИССЛЕДОВАНИЯ ЭЛАСТАЗЫ Иммуноферментный метод, использующий два различных типа моноклональных антител – «сендвич-метод». Иммуноферментный метод, использующий
- 45. ЛИПАЗА Катализирует гидролиз липидов до глицирина и жирных кислот, содержится почти во всех органах и тканях,
- 46. МЕТОДЫ ИССЛЕДОВАНИЯ ЛИПАЗЫ Классический метод определения активности липазы основан на определении количества образовавшихся из субстрата жирных
- 47. ХРОНИЧЕСКИЙ ПАНКРЕАТИТ Хронический панкреатит (ХП) — воспалительное заболевание поджелудочной железы, характеризующееся прогрессирующей очаговой, сегментарной или диффузной
- 48. Исследование в период обострения хронического панкреатита Перечень лабораторных методов исследования в период обострения ХП: Общий анализ
- 49. Лабораторные показатели крови при обострении хронического панкреатита Активность сывороточной амилазы начинает повышаться через 2—12 ч от
- 50. Лабораторные показатели крови при обострении хронического панкреатита При метастазировании опухоли в печень, сдавлении опухолью холедоха, особенно
- 51. Таким образом, клинико-лабораторная программа диагностики представленных вариантов ХП поможет врачам в распознавании заболеваний, рациональном построении лечебных
- 52. Лабораторная методы диагностики Helicobacter pylori- ассоциированных заболеваний желудка и двенадцатиперстной кишки Гистологический метод - позволяет проводить
- 53. Серологический метод исследования Агрессия НР и колонизация слизистой оболочки желудка вызывает системный иммунный ответ. В результате
- 54. Серологический метод исследования Современные подходы в диагностике инфекций НР включают методы исследования, которые представляют собой различные
- 55. Диагностика целиакии Относится к аутоиммунным HLA-ассоциированным заболеваниям, известная как глютен-чувствительная энтеропатия, характеризующаяся поражением тонкого кишечника, диареей,
- 56. Диагностика целиакии Современные методы серологической диагностики основываются не только на определении антител к глиадину, но и
- 58. Скачать презентацию






















































 Стол на 38 кувертов.
Стол на 38 кувертов. Презентация к уроку ОРКСЭ
Презентация к уроку ОРКСЭ Познавательная игра для внеклассных мероприятий по биологии
Познавательная игра для внеклассных мероприятий по биологии Презентация выступления на педагогическом совете 5.11.2013 Формирование универсальных учебных действий учащихся на уроках английского языка в средней школе
Презентация выступления на педагогическом совете 5.11.2013 Формирование универсальных учебных действий учащихся на уроках английского языка в средней школе Услуга настройки мобильного устройства в сети магазинов “5 элемент”
Услуга настройки мобильного устройства в сети магазинов “5 элемент” Конденсацияланған қатты денелердің құрылымы
Конденсацияланған қатты денелердің құрылымы Глобальные проблемы человечества
Глобальные проблемы человечества Adding forces
Adding forces Тема занятия: Мифические и животные существа в скульптуре Петербурга.
Тема занятия: Мифические и животные существа в скульптуре Петербурга. Пермский государственный национальный исследовательский университет
Пермский государственный национальный исследовательский университет Инструментальные методы исследования
Инструментальные методы исследования Классификация нарушений сознания
Классификация нарушений сознания 27 января - Международный день памяти жертв Холокоста
27 января - Международный день памяти жертв Холокоста Библиотеки пептидов и эпитопы
Библиотеки пептидов и эпитопы К актуализации опорных знаний 8 класс
К актуализации опорных знаний 8 класс Формула корней квадратного уравнения
Формула корней квадратного уравнения Современные требования по ведению текущей медицинской и учетно-отчетной документации на этапе ПМСП
Современные требования по ведению текущей медицинской и учетно-отчетной документации на этапе ПМСП Наполеоновские войны
Наполеоновские войны Использование шаблона технологической карты при планировании НОД
Использование шаблона технологической карты при планировании НОД Работа в компании Билайн
Работа в компании Билайн Money in the Past
Money in the Past Оригами. Пингвин.
Оригами. Пингвин. Пауэр-метал. Стиль метала
Пауэр-метал. Стиль метала Г.Х. Андерсен. Сказка “Гадкий утёнок”
Г.Х. Андерсен. Сказка “Гадкий утёнок” Основы технологии обучения. Организация, формы и методы проведения учебных занятий. (Лекция 5)
Основы технологии обучения. Организация, формы и методы проведения учебных занятий. (Лекция 5) Презентация для детей подготовительной группы Смешарики
Презентация для детей подготовительной группы Смешарики Тест по математике Деление десятичных дробей
Тест по математике Деление десятичных дробей Инструменты. Python. Библиотека trikRuntime
Инструменты. Python. Библиотека trikRuntime