Содержание
- 2. Выделение урана из растворов (пульп) к.т.н., доцент кафедры ХТРЭ Николай Степанович Тураев
- 3. ЖИДКИЕ АНИОНИТЫ Наибольшей основностью обладают соли четвертичных аммониевых оснований (ЧАО) (рабочая область рН=0–12). Часто используется хлорид
- 4. Сильное влияние на экстракцию оказывает разветвление в углеродной цепи алкильного радикала, которое вызывает стерические затруднения, экранируя
- 5. РАСЧЕТ КОЛИЧЕСТВА РАВНОВЕСНЫХ СТУПЕНЕЙ ЭКСТРАКЦИИ Количество вещества при однократном экстрагировании определяется величиной коэффициента распределения и соотношением
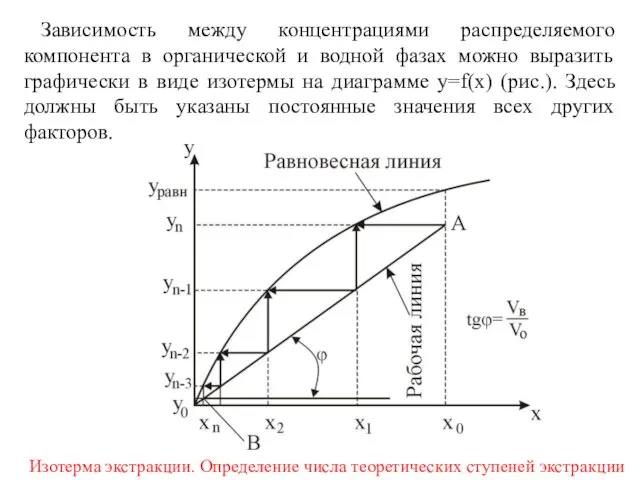
- 6. Зависимость между концентрациями распределяемого компонента в органической и водной фазах можно выразить графически в виде изотермы
- 7. Статика процессов экстракции обычно характеризуется количеством равновесных ступеней, необходимых для получения заданной эффективности разделения. Экстракционной ступенью
- 8. Чаще используется противоточная многоступенчатая экстракция. Здесь для получения водного раствора заданного состава требуется большее количество ступеней
- 9. Расчет от ступени к ступени можно начинать и слева и справа. Материальный баланс по урану для
- 10. Если начинать расчет справа, то составляем материальный баланс по урану для n-ступени: учитывая определяем xn-1. Материальный
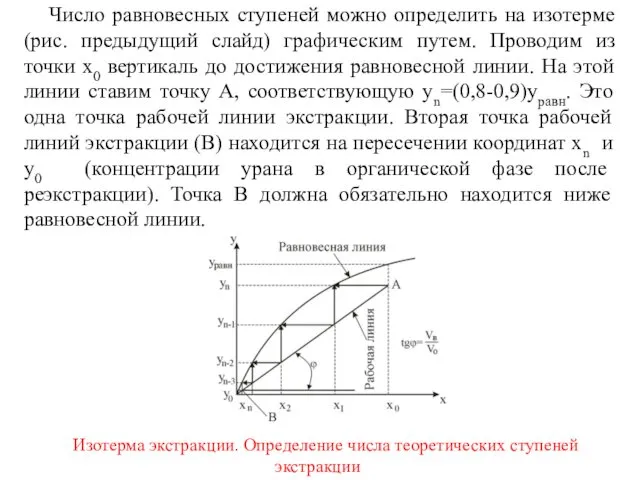
- 11. Число равновесных ступеней можно определить на изотерме (рис. предыдущий слайд) графическим путем. Проводим из точки x0
- 12. Точки на прямой АВ удовлетворяют уравнению Следовательно, АВ является рабочей линией процесса экстракции, а tgα определяет
- 13. Чтобы увеличить концентрацию урана в экстракте, нужно использовать системы с большими значениями коэффициента распределения. Тогда мы
- 14. КИНЕТИКА ПРОЦЕССА ЭКСТРАКЦИИ Скорость установления равновесного распределения вещества между водной и органической фазами определяется: скоростью массопередачи
- 15. Зеликман, Вольдман приводят следующее кинетическое уравнение где – степень достижения равновесного состояния, здесь F - поверхность
- 16. При a=const решение данного уравнения следующее: Уравнение почти аналогично кинетическому уравнению пленочной кинетики для ионообменного процесса.
- 17. Но во всех случаях скорость процесса пропорциональна поверхности раздела фаз. Для увеличения поверхности раздела фаз прибегают
- 18. ИЗВЛЕЧЕНИЕ УРАНА ИЗ РАСТВОРОВ С ПРИМЕНЕНИЕМ ЭКСТРАКЦИИ Наибольшей селективностью по отношению к урану обладают нейтральные экстрагенты.
- 19. Хорошо экстрагируется трехвалентное железо, поэтому перед экстракцией его лучше восстановить до двухвалентного состояния. Увеличение длины алкила
- 20. ЭГФК находится в органической фазе в димеризованной форме: В слабокислой среде ЭГФК экстрагирует катионы по катионообменному
- 22. Скачать презентацию

















 Волновая оптика. Дифракция света
Волновая оптика. Дифракция света Маршал Жуков Георгий Константинович (1896-1974)
Маршал Жуков Георгий Константинович (1896-1974) Родительское собрание в 1 классе Первый раз в первый класс
Родительское собрание в 1 классе Первый раз в первый класс Давление. Единицы давления
Давление. Единицы давления Перша світова війна. Період громадянської війни та української революції. Микола Куліш
Перша світова війна. Період громадянської війни та української революції. Микола Куліш Программа кружковой деятельности Говорушка
Программа кружковой деятельности Говорушка Теории личностного поведения
Теории личностного поведения БМСК жағдайындағы көмек көрсету қағидалары
БМСК жағдайындағы көмек көрсету қағидалары Дислалия. Примерные сроки появления речевых звуков в нормальном онтогенезе
Дислалия. Примерные сроки появления речевых звуков в нормальном онтогенезе Конструкции сушильных установок
Конструкции сушильных установок Товароведение и экспертиза средств производства
Товароведение и экспертиза средств производства Требования безопасности личного состава при проведении аварийно-спасательных работ и меры безопасности при проведении АСР
Требования безопасности личного состава при проведении аварийно-спасательных работ и меры безопасности при проведении АСР Репродуктивное здоровье. Инфекции, передаваемые половым путем, и их возбудители
Репродуктивное здоровье. Инфекции, передаваемые половым путем, и их возбудители Презентация Человек и гидросфера
Презентация Человек и гидросфера Агата Мэри Кларисса Кристи
Агата Мэри Кларисса Кристи Python Programming Language Foundation. Session 6
Python Programming Language Foundation. Session 6 Формы организации обучения
Формы организации обучения Презентация по химии для 10 класса по теме Сложные эфиры
Презентация по химии для 10 класса по теме Сложные эфиры Четвёртая власть и её роль в политической жизни обществ
Четвёртая власть и её роль в политической жизни обществ Строительство оснований и покрытий из каменных материалов, обработанных органическими вяжущими
Строительство оснований и покрытий из каменных материалов, обработанных органическими вяжущими Классный час Мягкие лапки, а в лапках царапки.
Классный час Мягкие лапки, а в лапках царапки. Совместная работа детского сада и семьи в условиях внедрения федеральных государственных требований
Совместная работа детского сада и семьи в условиях внедрения федеральных государственных требований Железодефицитная анемия у детей
Железодефицитная анемия у детей Аварийные химические отравляющие вещества (АХОВ). Способы помощи при АОХВ. 4 лекция
Аварийные химические отравляющие вещества (АХОВ). Способы помощи при АОХВ. 4 лекция Вера как дар
Вера как дар Формирование монологической связной речи
Формирование монологической связной речи Роспотребнадзор. Функции
Роспотребнадзор. Функции Уголок природы Осень
Уголок природы Осень