Механизмы окислительной модификации макромолекул. Материал для студентов ЛФ(стоматология) презентация
Содержание
- 2. Предмет изучения: - понятие об окислительной модификации мак- ромолекул (ОММ), локализации и механизмах, - основные субстраты
- 3. Место ОММ в разделах биохимии Статическая биохимия – раздел о химическом составе организма, структуре и свойствах
- 5. ОКИСЛИТЕЛЬНЫЙ СТРЕСС (ОС)
- 6. Ферментативные (дыхательная цепь МХ, микросомальное окисление, респираторный взрыв, ксантиноксидаза и др.) Неферментативные (свободные радикалы, АФК, ионы
- 8. I КЛАСС ферментов ОКСИДОРЕДУКТАЗЫ катализ окислительно-восстановительных реакций, лежащих в основе биологического окисления, микросомального окисления, перекисного окисления.
- 9. Роль кофакторов в ОВР 1) кофакторы хромопротеинов Сочетание белков с окрашенными веществами: флаво-, гемо-, ретинальпротеины и
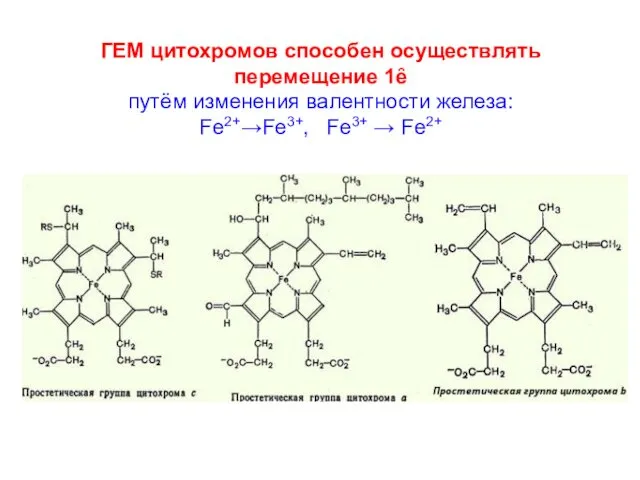
- 10. ГЕМ цитохромов способен осуществлять перемещение 1ȇ путём изменения валентности железа: Fe2+→Fe3+, Fe3+ → Fe2+
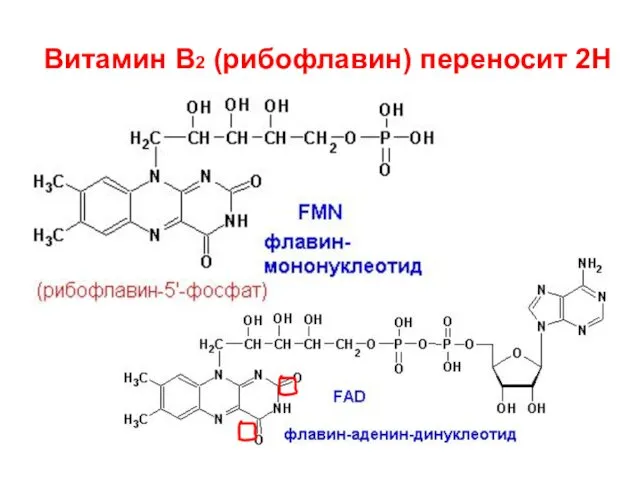
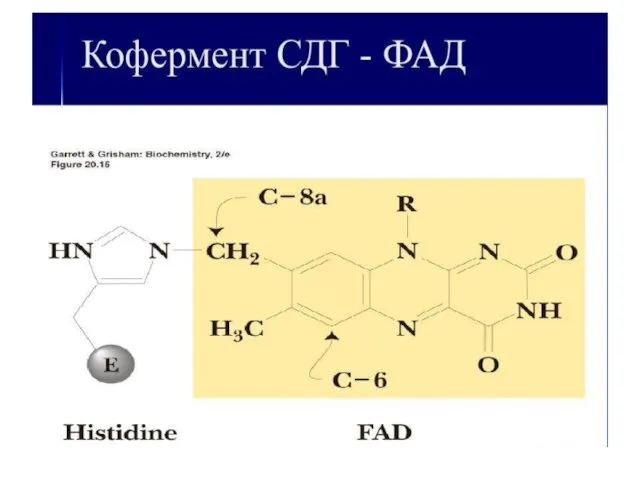
- 11. Витамин B2 (рибофлавин) переносит 2Н
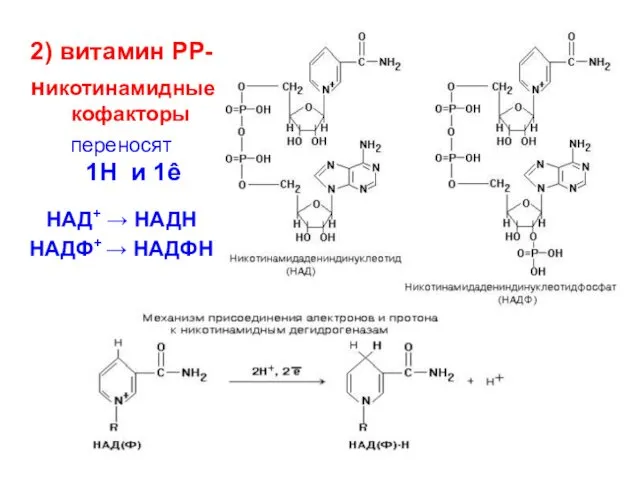
- 13. 2) витамин РР- никотинамидные кофакторы переносят 1Н и 1ê НАД+ → НАДН НАДФ+ → НАДФН
- 14. СУБСТРАТЫ процессов ОММ Субстраты-макромолекулы: - белки (АК, полипептидная цепь), - нуклеиновые кислоты (азотистые основания, D-рибоза цепи
- 15. Жизнь – водная форма существования белковых тел Информация об организме записана в генах (ДНК). Реализация информации
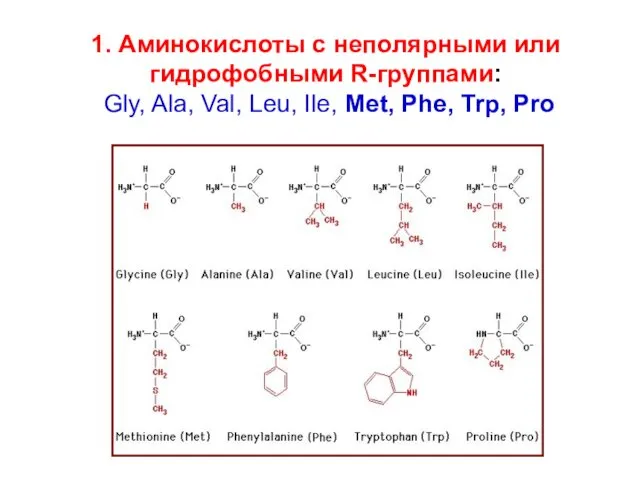
- 16. 1. Аминокислоты с неполярными или гидрофобными R-группами: Gly, Ala, Val, Leu, Ile, Met, Phe, Trp, Pro
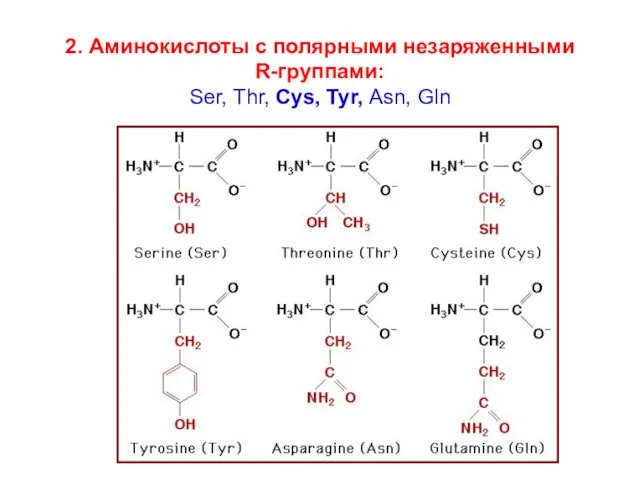
- 17. 2. Аминокислоты с полярными незаряженными R-группами: Ser, Thr, Cys, Tyr, Asn, Gln
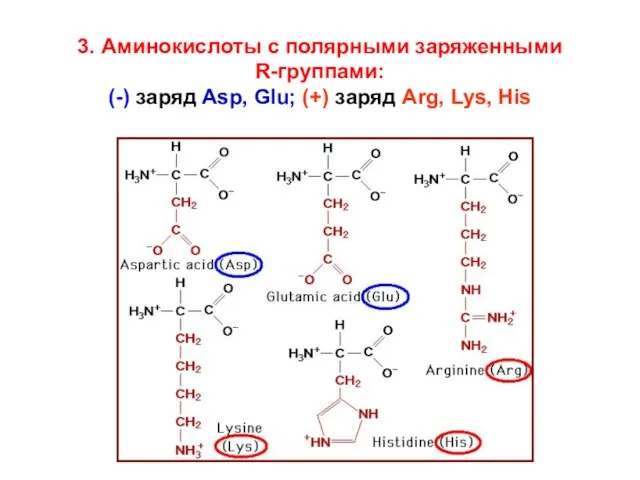
- 18. 3. Аминокислоты с полярными заряженными R-группами: (-) заряд Asp, Glu; (+) заряд Arg, Lys, His
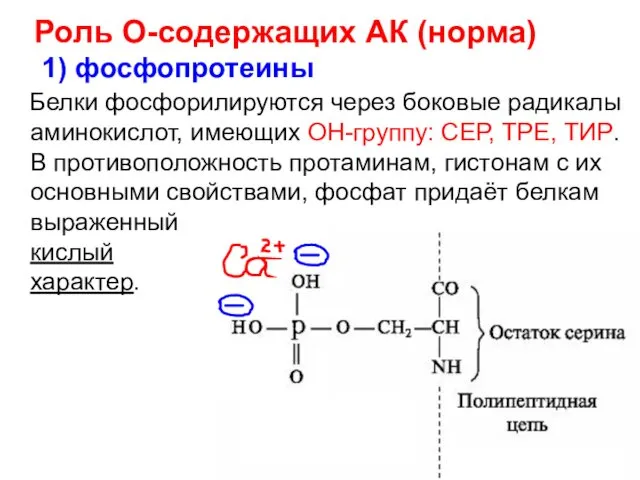
- 19. Роль О-содержащих АК (норма) 1) фосфопротеины Белки фосфорилируются через боковые радикалы аминокислот, имеющих ОН-группу: СЕР, ТРЕ,
- 20. 2) гликопротеины, протеогликаны Содержат углеводную часть, соединённую с белком ковалентно через боковые радикалы СЕР, ТРЕ (атом
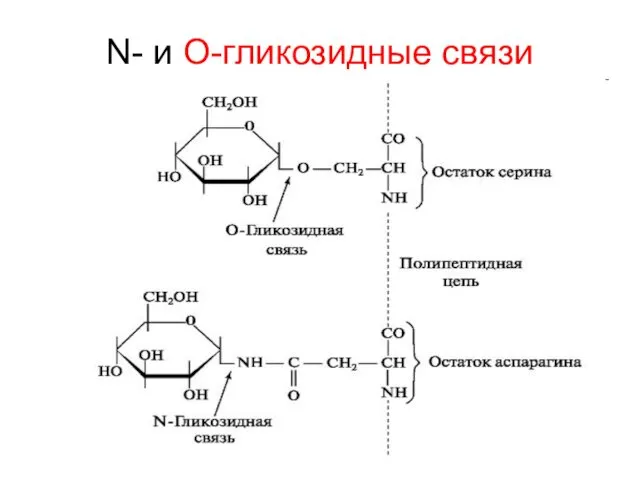
- 21. N- и O-гликозидные связи
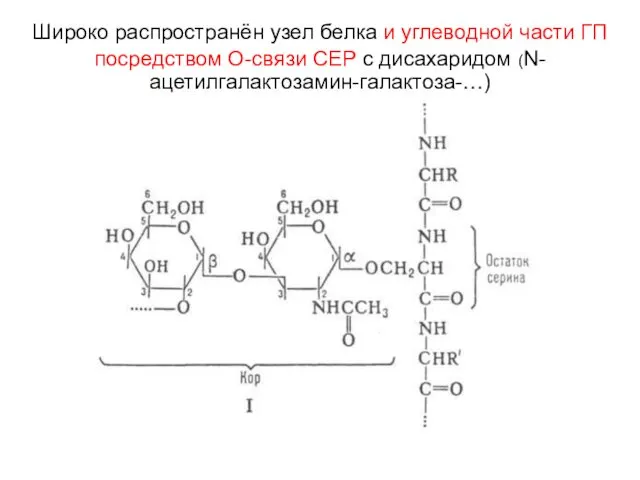
- 22. Широко распространён узел белка и углеводной части ГП посредством О-связи СЕР с дисахаридом (N-ацетилгалактозамин-галактоза-…)
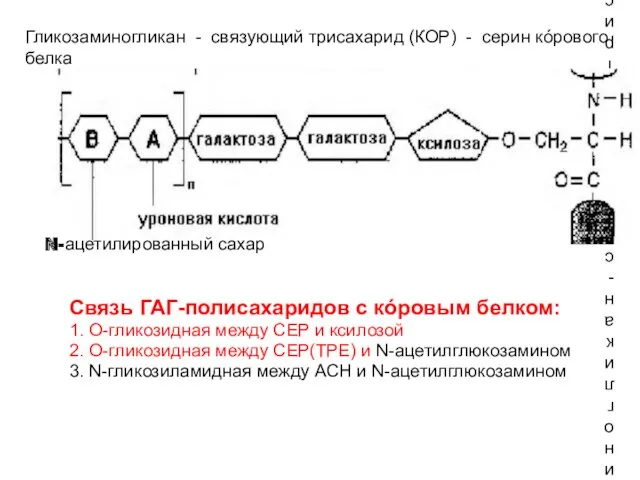
- 23. Гликозаминогликан - связующий трисахарид (КОР) - серин кóрового белка Связь ГАГ-полисахаридов с кóровым белком: 1. О-гликозидная
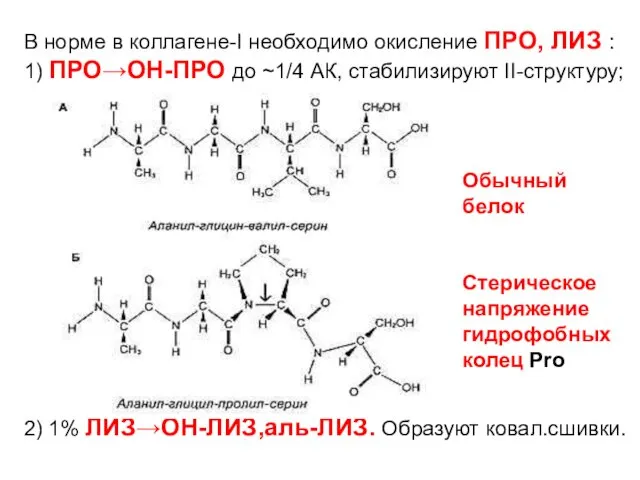
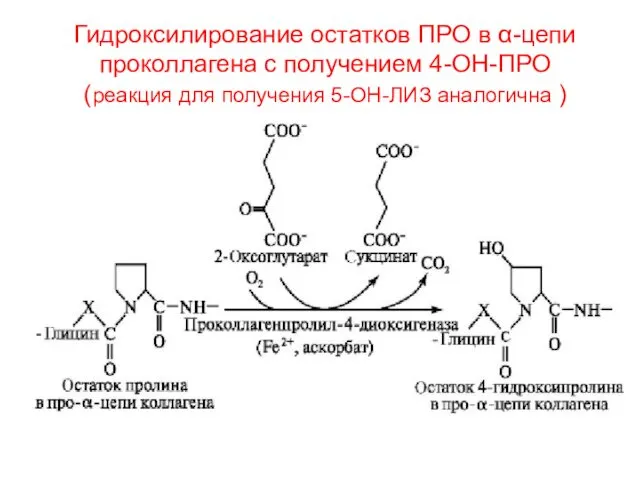
- 24. В норме в коллагене-I необходимо окисление ПРО, ЛИЗ : 1) ПРО→ОН-ПРО до ~1/4 АК, стабилизируют II-структуру;
- 25. Гидроксилирование остатков ПРО в α-цепи проколлагена с получением 4-ОН-ПРО (реакция для получения 5-ОН-ЛИЗ аналогична )
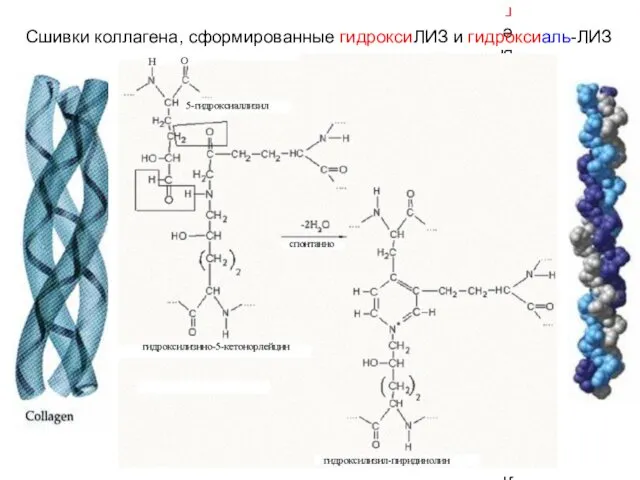
- 26. Сшивки коллагена, сформированные гидроксиЛИЗ и гидроксиаль-ЛИЗ Сшивки коллагена, сформированные гидроксиЛИЗ и гидроксиаль-ЛИЗ
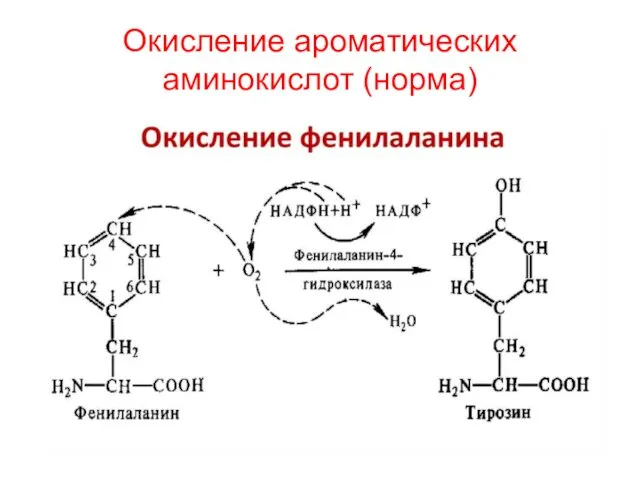
- 27. Окисление ароматических аминокислот (норма)
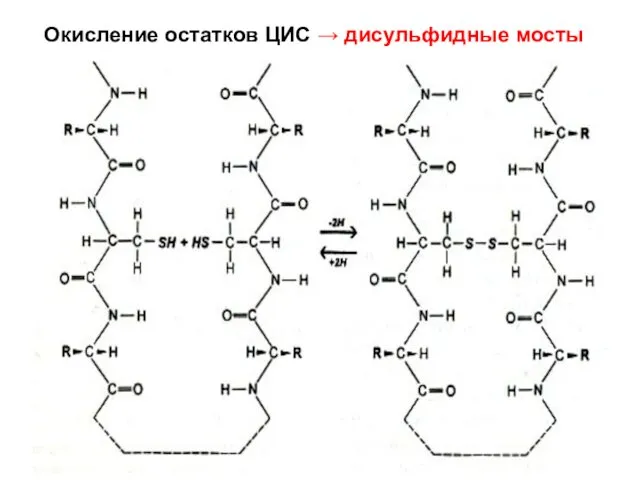
- 28. Окисление остатков ЦИС → дисульфидные мосты
- 29. В ходе синтеза белка SS-связи образуются при спонтанном окислении SH-групп сближающихся остатков ЦИС первичной структуры. Особо
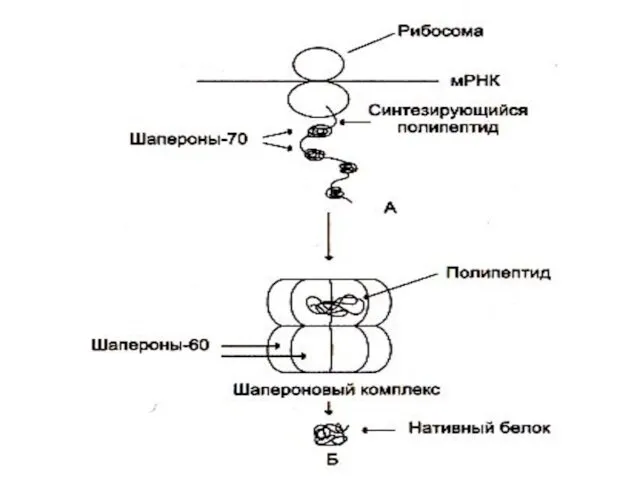
- 30. Фолдинг – спонтанное сворачивание синтезированной полипептидной цепи в уникальную пространственную структуру: на внешней поверхности глобулы белка
- 32. ДЕНАТУРАЦИЯ БЕЛКА при ОС окисление и осаждение белка с нарушением пространственной структуры и потерей биологических свойств.
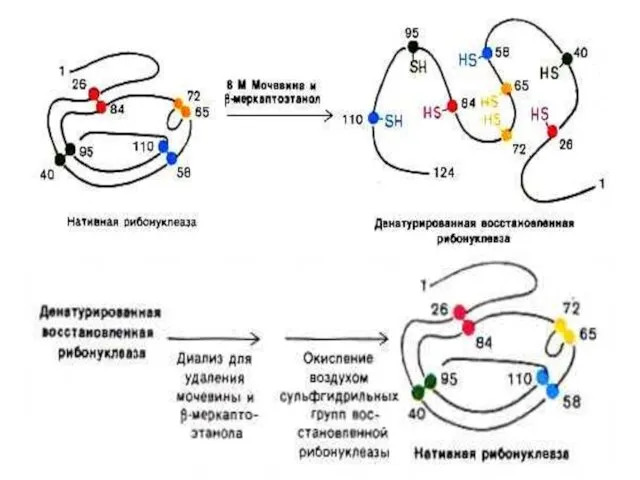
- 33. Обратимое окисление и РЕНАТУРАЦИЯ При ренатурации белок вновь сворачивается в нативную конформацию и его биологическая активность
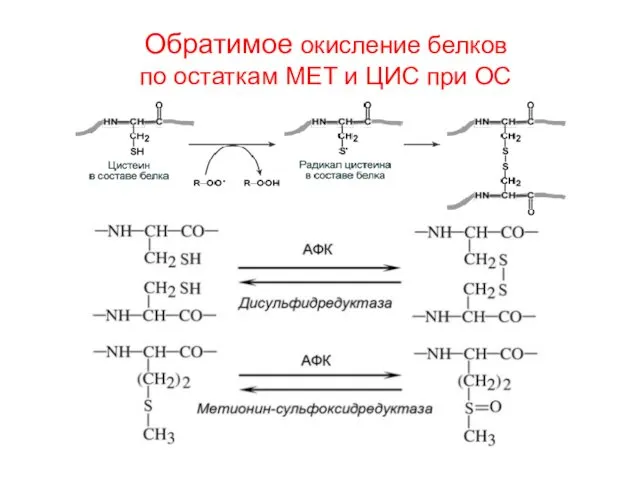
- 34. Обратимое окисление белков по остаткам МЕТ и ЦИС при ОС
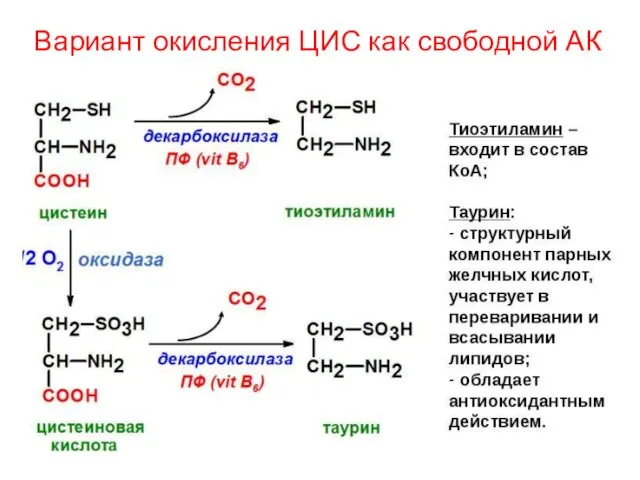
- 36. Вариант окисления ЦИС как свободной АК
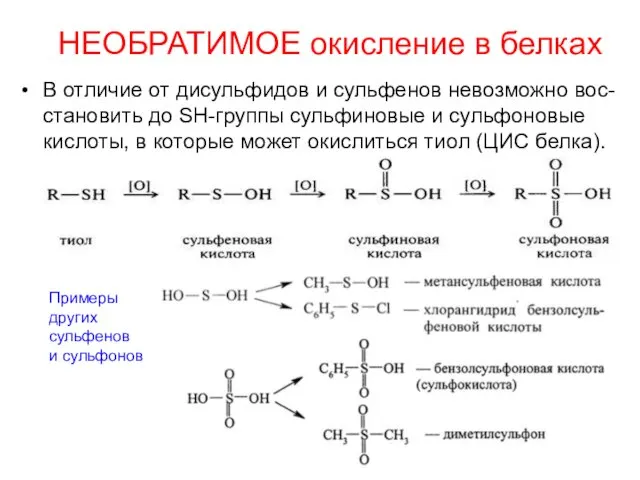
- 37. НЕОБРАТИМОЕ окисление в белках В отличие от дисульфидов и сульфенов невозможно вос-становить до SH-группы сульфиновые и
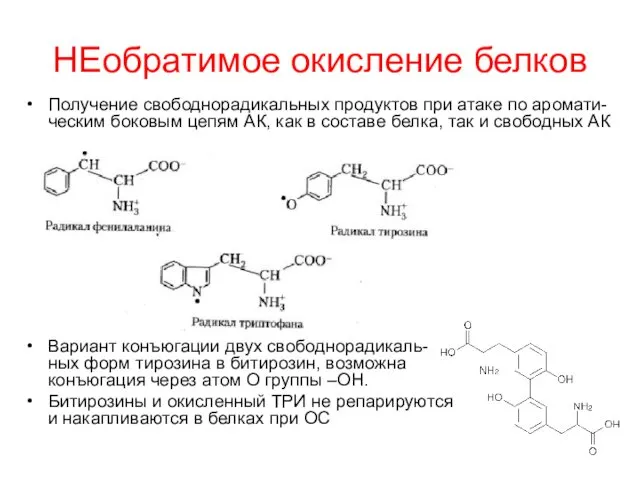
- 38. НЕобратимое окисление белков Получение свободнорадикальных продуктов при атаке по аромати-ческим боковым цепям АК, как в составе
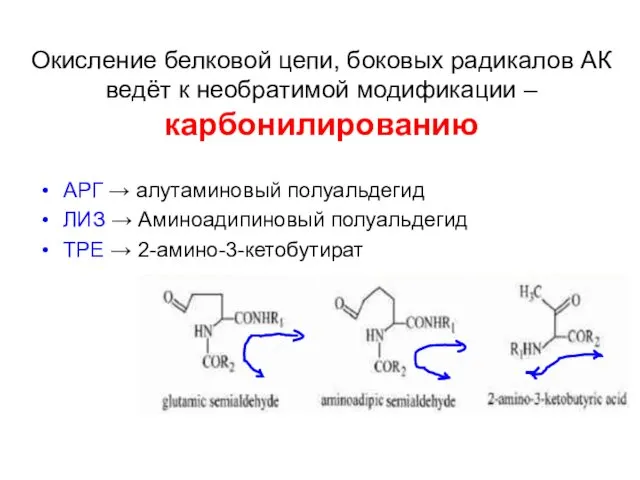
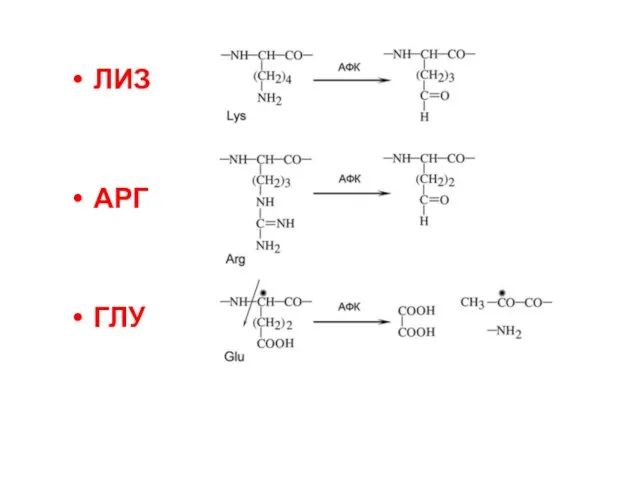
- 39. Окисление белковой цепи, боковых радикалов АК ведёт к необратимой модификации – карбонилированию АРГ → алутаминовый полуальдегид
- 40. ЛИЗ АРГ ГЛУ
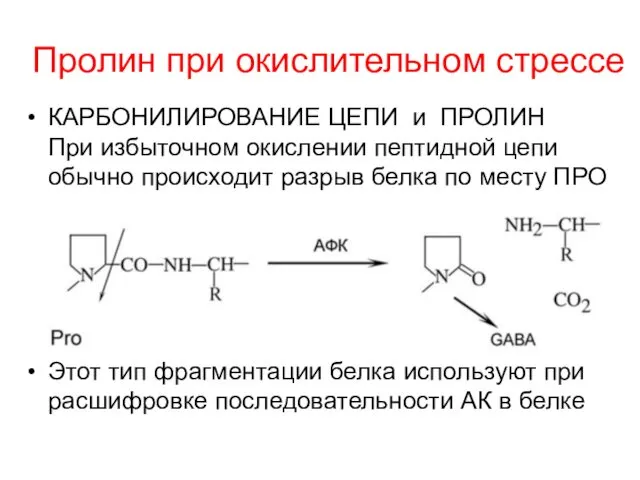
- 41. Пролин при окислительном стрессе КАРБОНИЛИРОВАНИЕ ЦЕПИ и ПРОЛИН При избыточном окислении пептидной цепи обычно происходит разрыв
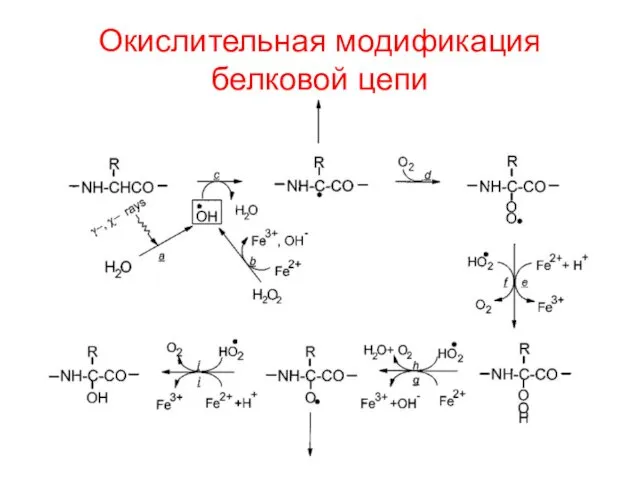
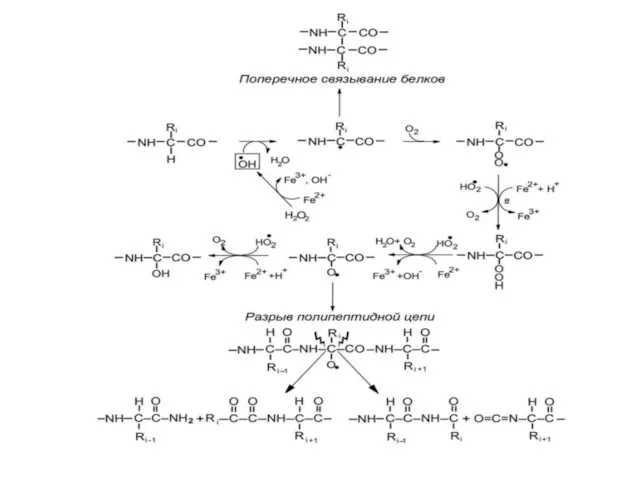
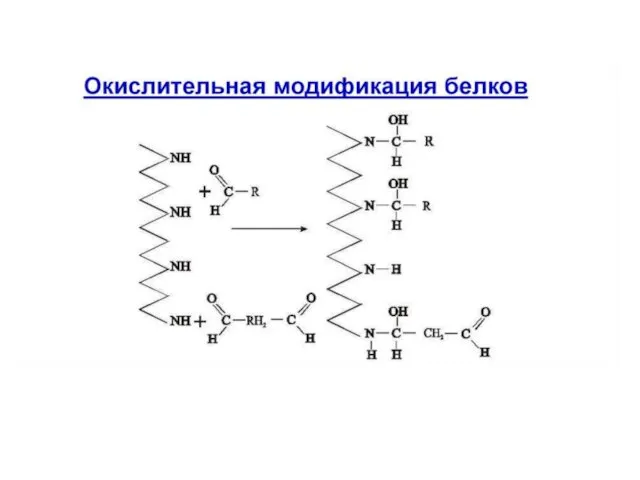
- 42. Окислительная модификация белковой цепи
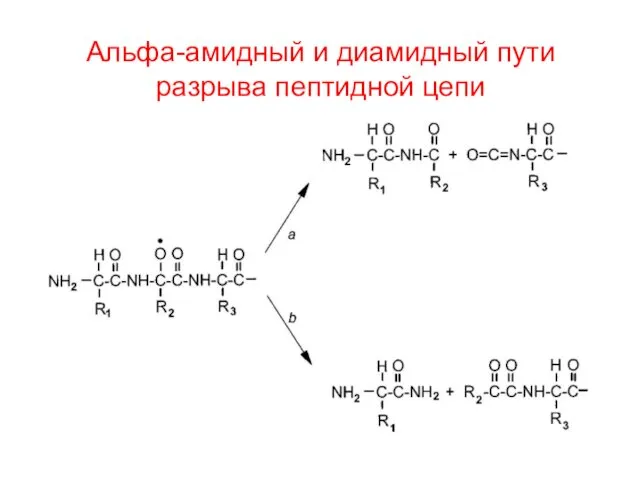
- 44. Альфа-амидный и диамидный пути разрыва пептидной цепи
- 45. Металлопротеины Содержат ионы одного или нескольких металлов. Характерна связь ионов с Асп, Глу, Цис, Гис белка
- 46. Fe(II) - Fe(III) и другие металлы с переменной валентностью Белки-металлопротеины Связывание металлов предупреждает металл-катализируемое окисление (МКО)
- 47. металлы с переменной валентностью
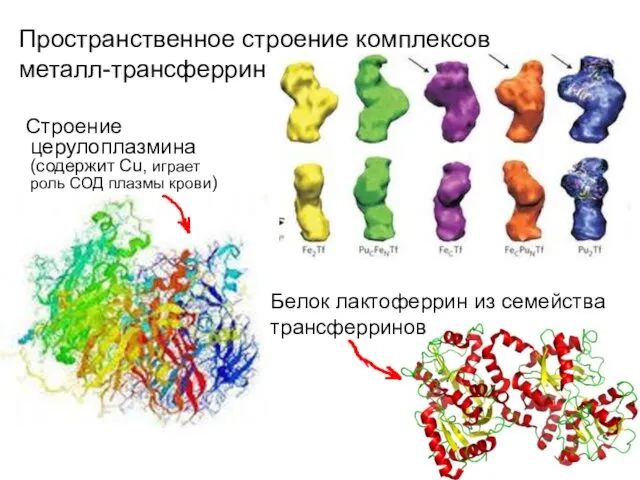
- 48. Пространственное строение комплексов металл-трансферрин Строение церулоплазмина (содержит Cu, играет роль СОД плазмы крови) Белок лактоферрин из
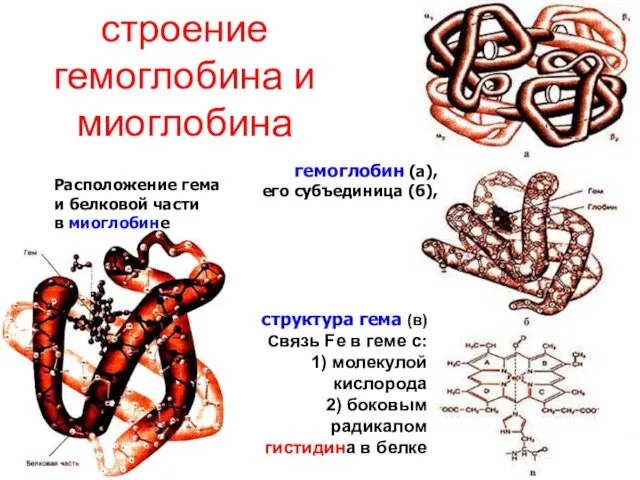
- 49. строение гемоглобина и миоглобина гемоглобин (а), его субъединица (б), Расположение гема и белковой части в миоглобине
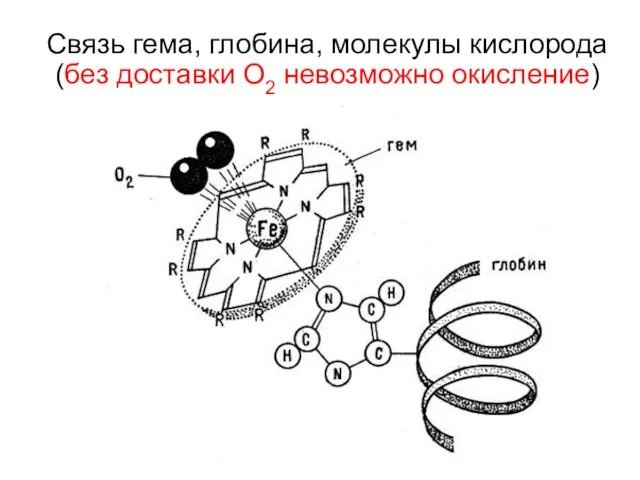
- 50. Связь гема, глобина, молекулы кислорода (без доставки О2 невозможно окисление)
- 51. Удаление окисленных белков Необратимо повреждённые белки могут разрушаться несколькими способами: 1) протеазы (с разной субстратной специфичностью)
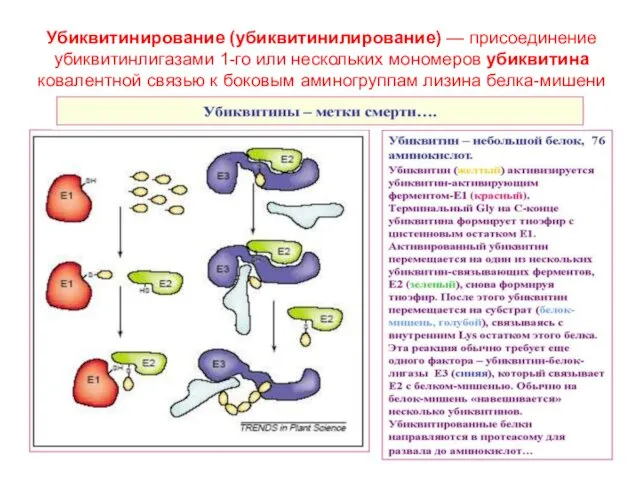
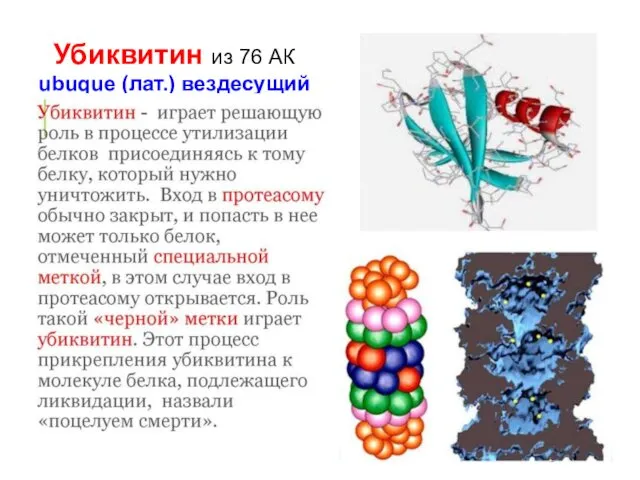
- 52. Убиквитинирование (убиквитинилирование) — присоединение убиквитинлигазами 1-го или нескольких мономеров убиквитина ковалентной связью к боковым аминогруппам лизина
- 53. Убиквитин из 76 АК ubuque (лат.) вездесущий
- 54. Нуклеопротеины и окислительная модификация нуклеиновых кислот (ОМНК) Апобелки НП защищают нуклеиновые кислоты от окисления и иных
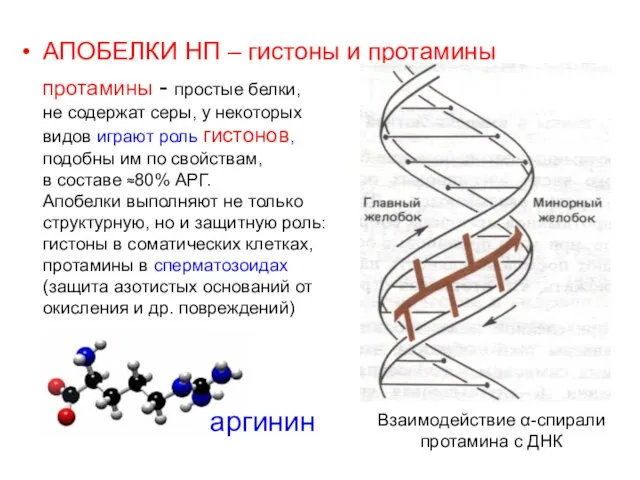
- 55. АПОБЕЛКИ НП – гистоны и протамины протамины - простые белки, не содержат серы, у некоторых видов
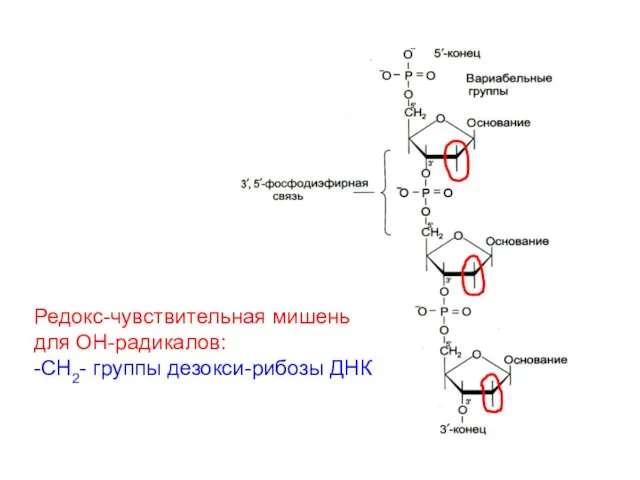
- 56. Редокс-чувствительная мишень для ОН-радикалов: -СН2- группы дезокси-рибозы ДНК
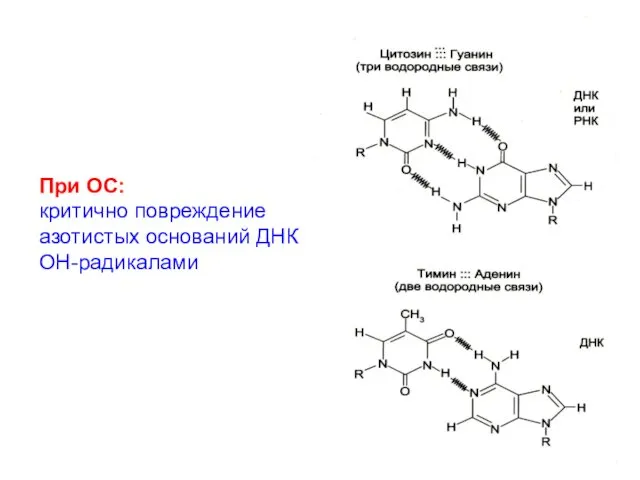
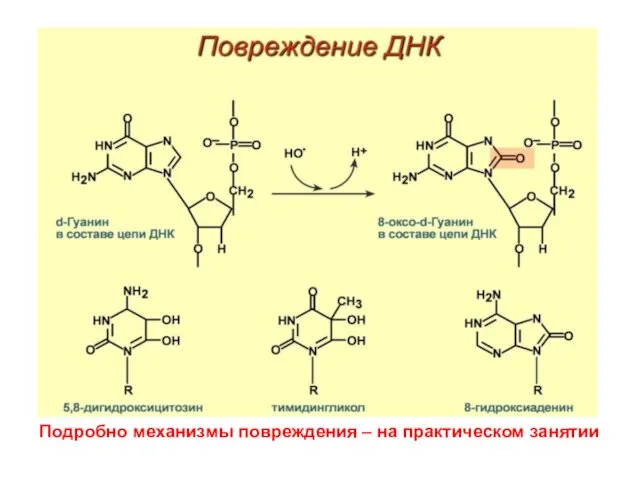
- 57. При ОС: критично повреждение азотистых оснований ДНК ОН-радикалами
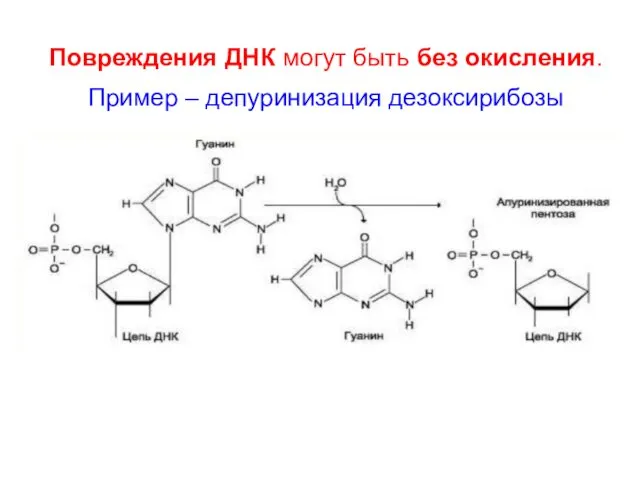
- 58. Повреждения ДНК могут быть без окисления. Пример – депуринизация дезоксирибозы
- 59. Подробно механизмы повреждения – на практическом занятии
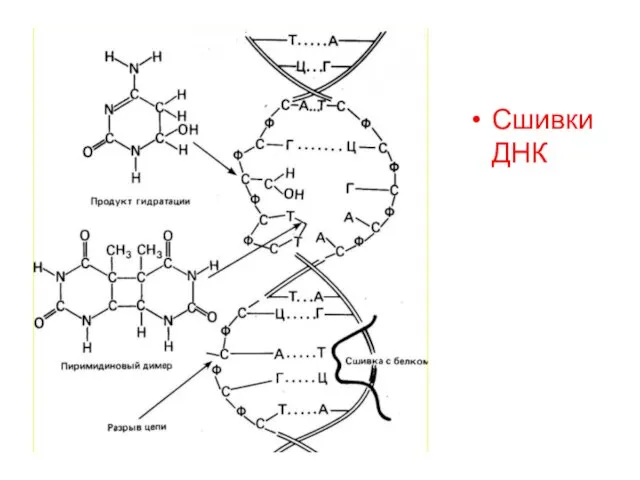
- 60. Сшивки ДНК
- 61. Окислительная модификация липидов – это перекисное окисление липидов (ПОЛ) Плазматическая мембрана клетки и транспортные липопротеины содержат
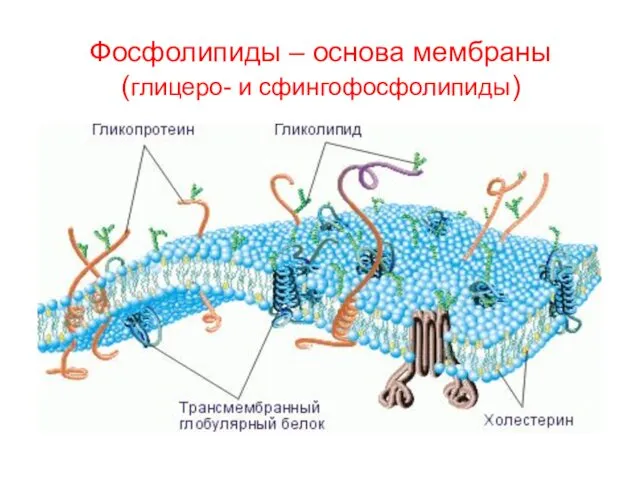
- 62. Фосфолипиды – основа мембраны (глицеро- и сфингофосфолипиды)
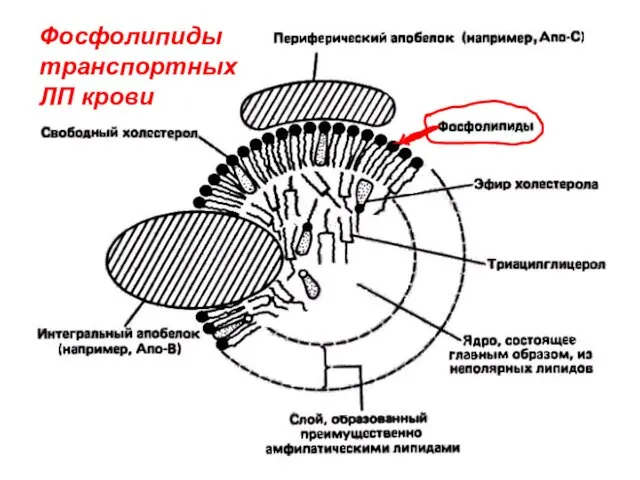
- 63. Фосфолипиды транспортных ЛП крови
- 64. Липопротеины (ЛП) 1) транспортные ЛП крови – надмолекулярные структуры, содержат все классы липидов и белки, контакт
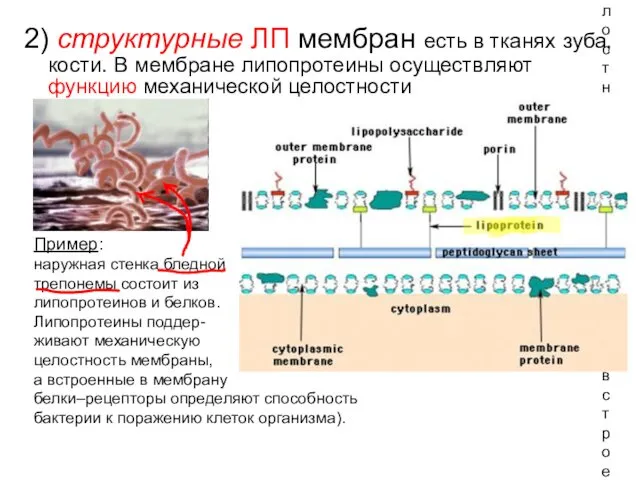
- 65. Пример: наружная стенка бледной трепонемы состоит из липопротеинов и белков. Липопротеины поддер- живают механическую целостность мембраны,
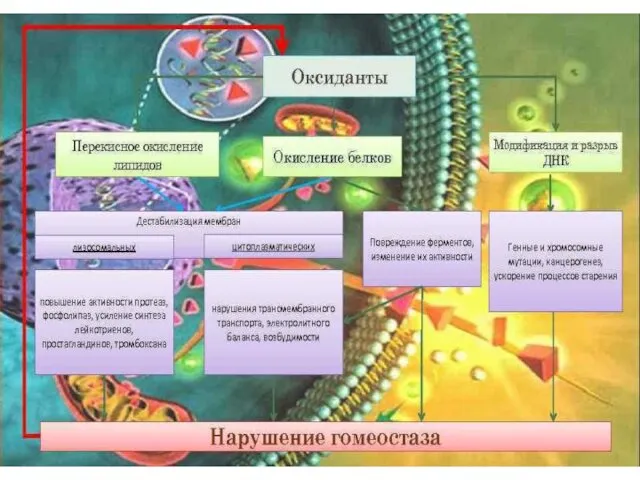
- 66. Окислительный стресс
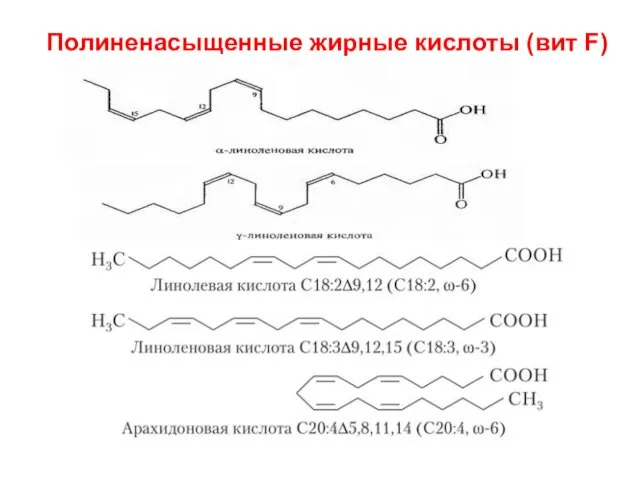
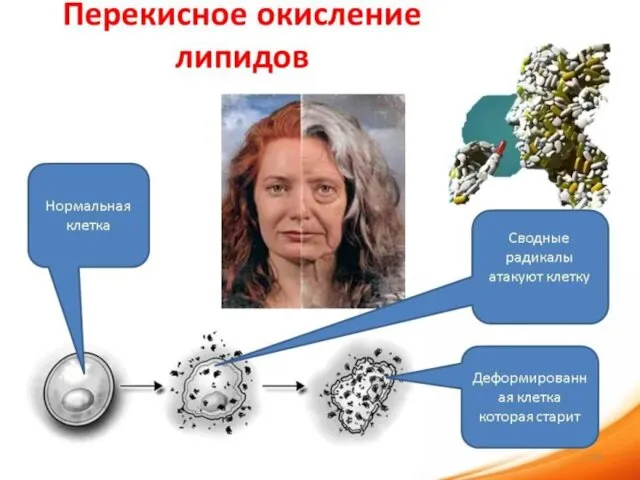
- 67. Полиненасыщенные жирные кислоты (вит F)
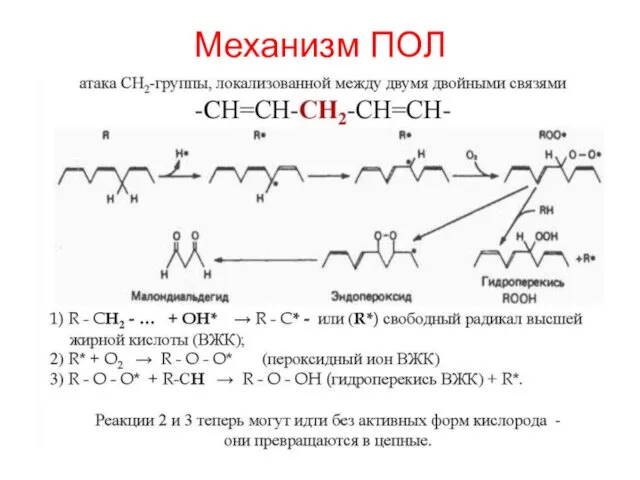
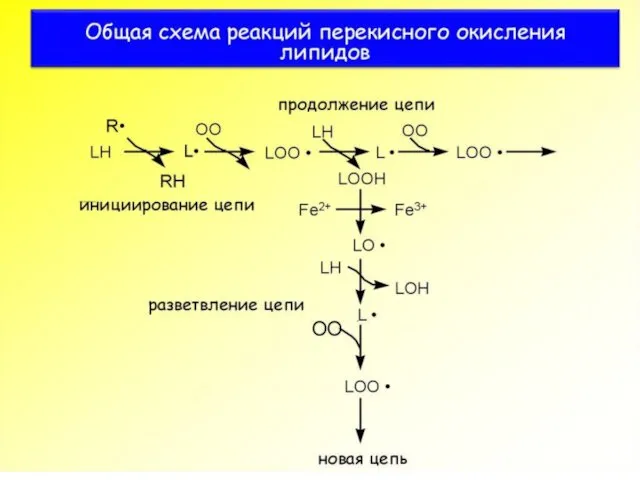
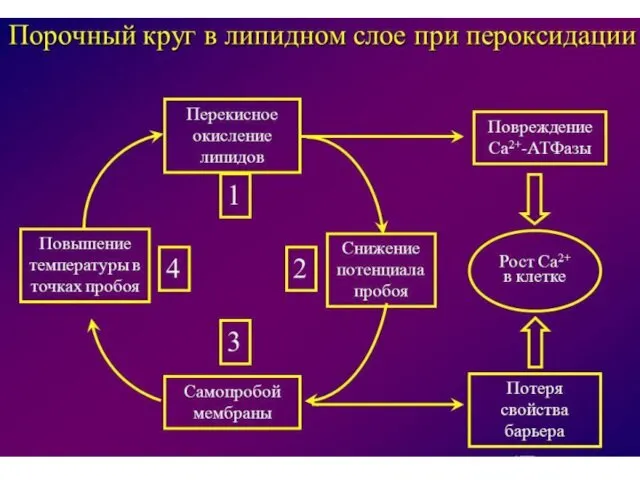
- 68. Механизм ПОЛ
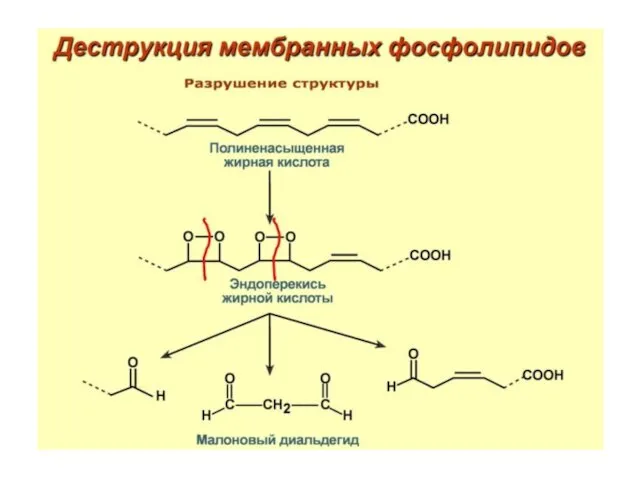
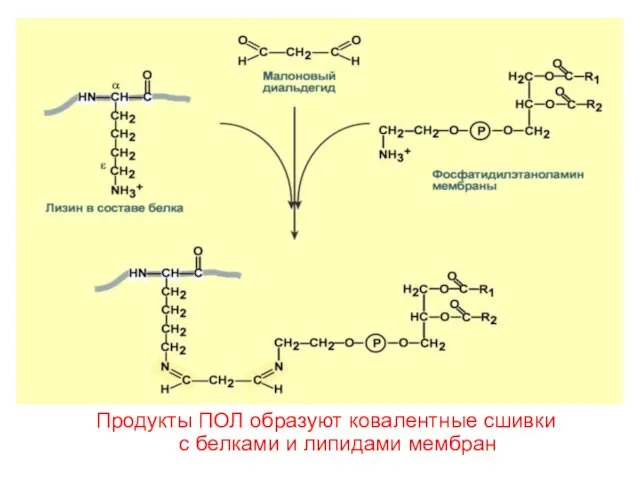
- 71. Продукты ПОЛ образуют ковалентные сшивки с белками и липидами мембран
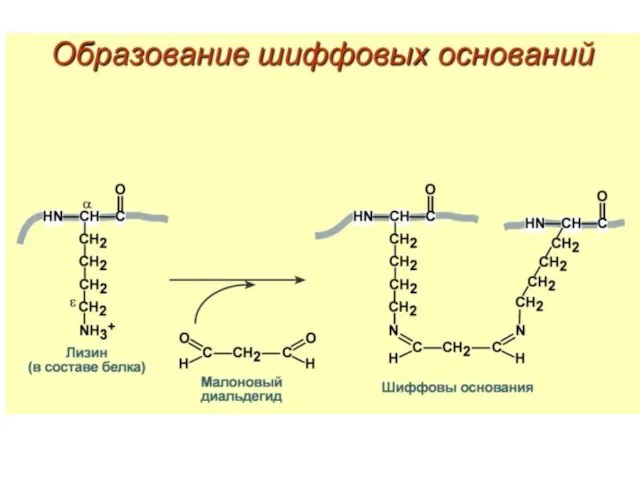
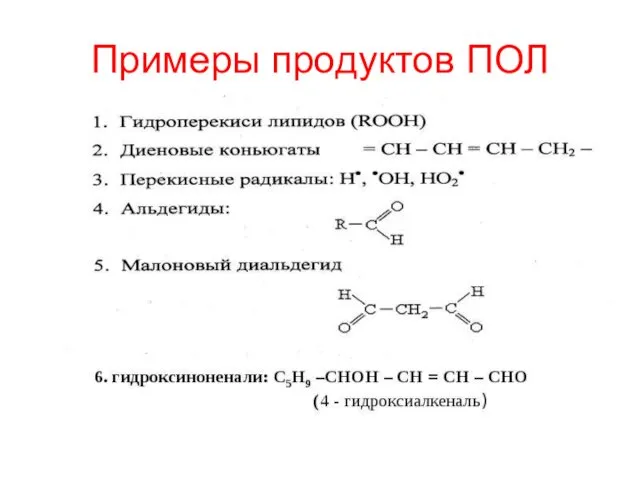
- 74. Примеры продуктов ПОЛ
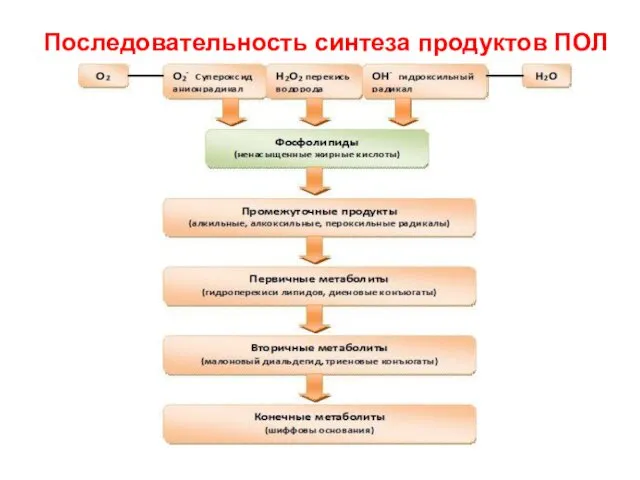
- 75. Последовательность синтеза продуктов ПОЛ
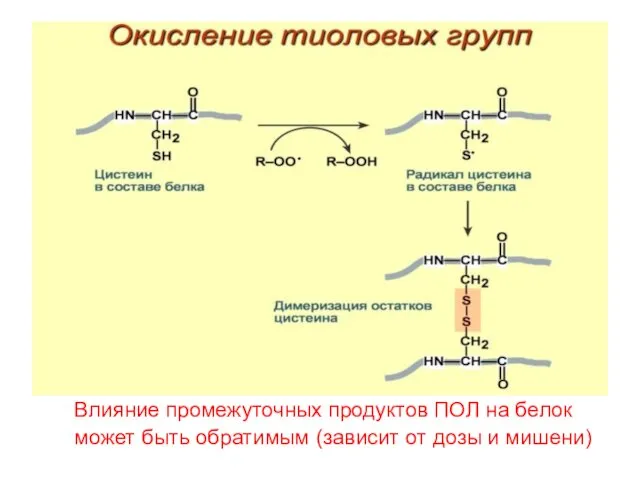
- 76. Влияние промежуточных продуктов ПОЛ на белок может быть обратимым (зависит от дозы и мишени)
- 81. Скачать презентацию























 Laser technologies of Triniti JSC
Laser technologies of Triniti JSC Основные понятия и процессы, определяющие бурение скважины в осложненных и аварийных условиях. Лекция 1
Основные понятия и процессы, определяющие бурение скважины в осложненных и аварийных условиях. Лекция 1 Свет души Презентация для осеннего бала.
Свет души Презентация для осеннего бала. Люди, животные, растения и минералы
Люди, животные, растения и минералы Площадь поверхности
Площадь поверхности Проект Гольф в школу
Проект Гольф в школу Правила дорожного движения
Правила дорожного движения Радіоприймальні пристрої ЗРЛ. Підсилювачі проміжної частоти і детектори. (Тема 4.3)
Радіоприймальні пристрої ЗРЛ. Підсилювачі проміжної частоти і детектори. (Тема 4.3) Глобальные проблемы человечества
Глобальные проблемы человечества Презентация. Поэты и Менделеев.
Презентация. Поэты и Менделеев. Маленький Мук, по сказке В. Гауфа
Маленький Мук, по сказке В. Гауфа Презентация Маленькая планета
Презентация Маленькая планета Рынок труда. Занятость и безработица
Рынок труда. Занятость и безработица Измерительные трансформаторы
Измерительные трансформаторы Подготовка спортсмена в Пауэрлифтинге
Подготовка спортсмена в Пауэрлифтинге Электронное пособие по развитию звукового анализа Мультяшки
Электронное пособие по развитию звукового анализа Мультяшки Хрящевая ткань
Хрящевая ткань Проект Молоко и его польза
Проект Молоко и его польза Лекция+5+Состав+преступления
Лекция+5+Состав+преступления Архитектура с общей шиной
Архитектура с общей шиной Аргументация и доказательство
Аргументация и доказательство Порядок составления заявки на ракетное топливо, горючее и смазочные материалы на год. Расчеты, расшифровки
Порядок составления заявки на ракетное топливо, горючее и смазочные материалы на год. Расчеты, расшифровки Профилактика гриппа и ОРВИ
Профилактика гриппа и ОРВИ Armelle - парфюмерная компания
Armelle - парфюмерная компания Участие во Всероссийской ярмарке и конкурсе событийного туризма
Участие во Всероссийской ярмарке и конкурсе событийного туризма Игра Самый умный
Игра Самый умный Northern Ireland
Northern Ireland Ақсу аудандандық ветеринариялық зертханасы
Ақсу аудандандық ветеринариялық зертханасы