Содержание
- 2. Металлы - вещества, обладающие в обычных условиях характерными металлическими свойствами: высокими электро- и теплопроводностью, блеском, пластичностью,
- 3. К металлам относят как собственно металлы (простые вещества: железо, медь и т.п.), так и их сплавы
- 4. КЛАССИФИКАЦИЯ МЕТАЛЛОВ Из 110 элементов в периодической системе - 86 металлы. По положению в периодической системе.
- 5. КЛАССИФИКАЦИЯ МЕТАЛЛОВ Выделяют: - щелочные металлы (Li, Na, K, Rb, Cs, Fr); - щелочно-земельные (Ca, Sr,
- 6. КЛАССИФИКАЦИЯ МЕТАЛЛОВ Техническая классификация Черные металлы (Fe, Mn и их сплавы); Тяжелые цветные металлы (Cu, Pb,
- 7. КЛАССИФИКАЦИЯ МЕТАЛЛОВ Техническая классификация Драгоценные металлы (Au, Ag, платиновые металлы); Легирующие металлы (Mn, Cr, W, Mo,
- 8. СТРОЕНИЕ МЕТАЛЛОВ Кристаллическая структура Большинство металлов кристаллизуется в одном из трех структурных типов: - с кубической
- 9. Переход из одной структуры в другую (полиморфные превращения) требуют Е ~ 1 кДж/моль. При изменении температуры
- 10. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ. ЗОННАЯ ТЕОРИЯ ЭЛЕКТРОННОГО СТРОЕНИЯ. Металлическая связь – химическая связь, обусловленная взаимодействием "электронного газа" (валентные
- 11. Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов [Глинка, с. 532]
- 12. Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов [Ахметов, с. 115]
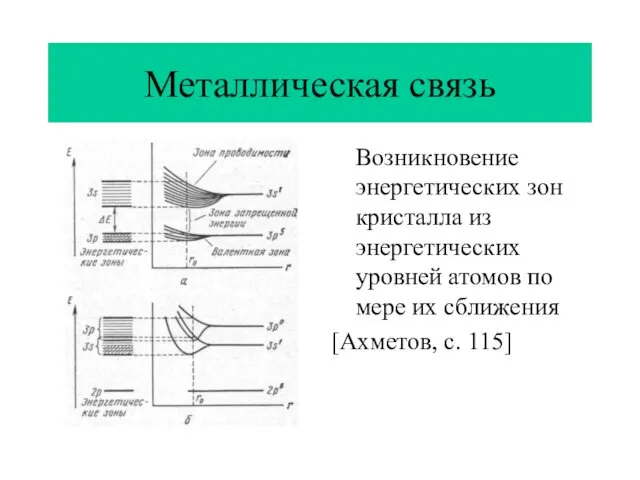
- 13. Металлическая связь Возникновение энергетических зон кристалла из энергетических уровней атомов по мере их сближения [Ахметов, с.
- 14. Металлическая связь Схема расположения энергетических зон в металле, изоляторе и полупроводнике [Глинка, с.534]
- 15. ОСОБЕННОСТИ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ МЕТАЛЛОВ 1) высокие электро- и теплопроводность; 2) пластичность; 3) металлический блеск и непрозрачность;
- 16. ОСОБЕННОСТИ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ МЕТАЛЛОВ Физические свойства металлов меняются в очень широких пределах. Например, Тпл от –390С
- 17. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Металлы – восстановители в химических реакциях. Окисление Большинство металлов окисляется кислородом воздуха. Скорость
- 18. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Окисление Защитная пленка (Al, Ti, Cr): Vоксида/ Vметалла>1 Металлы неустойчивы на воздухе: Vоксида/
- 19. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с неметаллами 2Al + 3I2 = 2AlI3 2Fe + 3Cl2 = 2FeCl3
- 20. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с водой Все металлы с Е0 2Na + 2HOH = 2NaOH +
- 21. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции со щелочами С растворами щелочей реагируют металлы, образующие растворимые анионные гидроксокомплексы (Be,
- 22. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с кислотами Большинство металлов реагируют (окисляются) теми или иными кислотами. а) неокисляющие
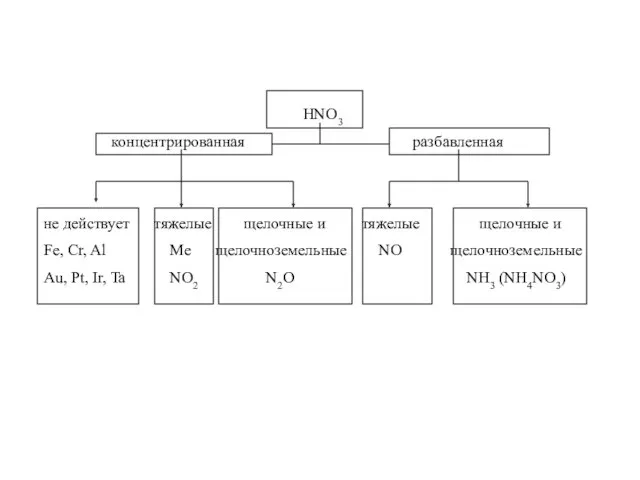
- 23. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с кислотами окисляющие кислоты (окислитель - элемент кислотного остатка) HNO3, H2SO4(конц) и
- 24. HNO3 концентрированная разбавленная не действует тяжелые щелочные и тяжелые щелочные и Fe, Cr, Al Me щелочноземельные
- 25. Примеры Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2⭡ + 2H2O 3Cu + 8HNO3(разб) = 3Cu(NO3)2 +
- 26. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с солями металлов Металлы могут восстанавливать ионы других металлов Fe + CuSO4
- 27. МЕТАЛЛЫ В ПРИРОДЕ. ПОЛУЧЕНИЕ МЕТАЛЛОВ ИЗ РУД
- 28. Металлы в природе Самородные металлы (Au (112 кг), Pt, Ag (13,5 т), Cu (420 т), Hg,
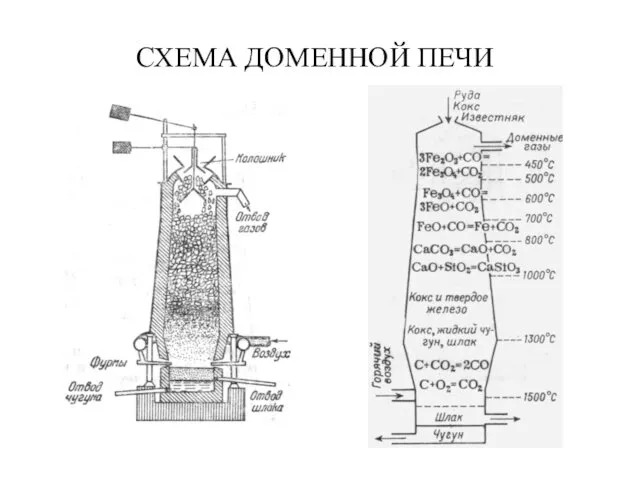
- 29. Способы получения металлов из руд Пирометаллургия (с помощью ОВР при высоких температурах) 2Fe2O3 + 3C 4Fe
- 30. СХЕМА ДОМЕННОЙ ПЕЧИ
- 31. Способы получения металлов из руд Металлотермия (восстановители - активные металлы: Al, Ca, Mg…) Fe2O3 + 2Al
- 32. Способы получения металлов из руд Гидрометаллургия (получение металлов из растворов их солей) CuO + H2SO4 →
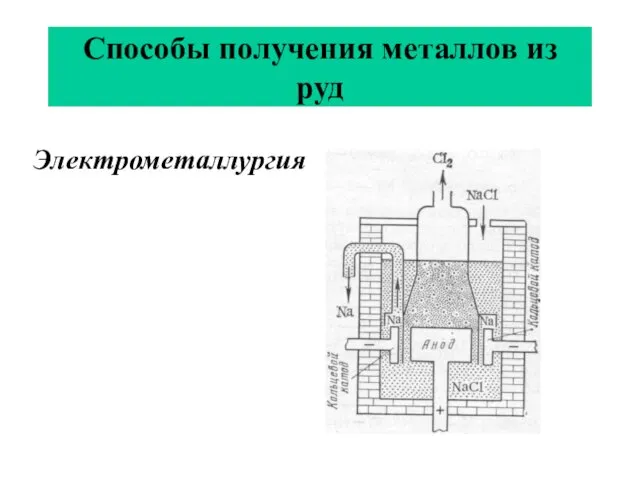
- 33. Способы получения металлов из руд Электрометаллургия (получение металлов с помощью электролиза). Электролизом получают щелочные металлы, Al.
- 34. Способы получения металлов из руд Электрометаллургия
- 35. Способы получения металлов из руд Металлы высокой чистоты (содержание примесей менее 10-8 % ) получают с
- 36. КОРРОЗИЯ МЕТАЛЛОВ
- 37. Коррозия - самопроизвольное разрушение металлических материалов из-за физико-химического взаимодействия с окружающей средой Мировые потери из-за коррозии
- 38. КЛАССИФИКАЦИЯ КОРРОЗИИ МЕТАЛЛОВ Классификация коррозии металлов определяется конкретными особенностями среды и условиями протекания процесса (подводом окислителя,
- 39. КЛАССИФИКАЦИЯ КОРРОЗИИ МЕТАЛЛОВ - атмосферная коррозия; - морская коррозия; - подземная коррозия; - биокоррозия ; -
- 40. Газовая коррозия Алюминий – Al(Al2O3) Если снять пленку Al2O3 (Al2O3 + 2NaOH → 2NaAlO2 + H2O)
- 41. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ В основе коррозии металлов - реакция между материалом и средой или между
- 42. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ Механизм коррозии металлов определяется типом агрессивной среды. газовая коррозия: лимитирующая стадия -
- 43. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ Электрохимическая коррозия Электрохимическая коррозия - разрушение металла в среде электролита с возникновением
- 44. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ Электрохимическая коррозия связана с возникновением гальванического элемента. Активный металл является анодом, отдает
- 45. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ В воде имеются окислители (Ох): 1) растворенный О2: О2 + 2Н2О +
- 46. Пример. Коррозия железа в контакте с медью в присутствии электролита. Процессы идут при рН = 7.
- 48. Скачать презентацию









![Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов [Глинка, с. 532]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/37107/slide-10.jpg)
![Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов [Ахметов, с. 115]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/37107/slide-11.jpg)
![Металлическая связь Схема расположения энергетических зон в металле, изоляторе и полупроводнике [Глинка, с.534]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/37107/slide-13.jpg)





























 Виды плана
Виды плана Родительское собрание о пользе здорового питания
Родительское собрание о пользе здорового питания КЛУБ-У – комплексное локомотивное устройство безопасности унифицированное
КЛУБ-У – комплексное локомотивное устройство безопасности унифицированное Библейские сказания. История Древнего мира
Библейские сказания. История Древнего мира Хирургические болезни тонкой и ободочной кишок
Хирургические болезни тонкой и ободочной кишок Эмиссионная ценная бумага облигация. (Тема 4)
Эмиссионная ценная бумага облигация. (Тема 4) Мастер-класс по изготовлению наглядного пособия День Победы
Мастер-класс по изготовлению наглядного пособия День Победы Transport of the future
Transport of the future Формування конкурентноздатної команди
Формування конкурентноздатної команди Сбор и переработка мусора
Сбор и переработка мусора Воспалительные заболевания кишечника
Воспалительные заболевания кишечника Проектирования системы пожарной сигнализации и оповещения о пожаре
Проектирования системы пожарной сигнализации и оповещения о пожаре Ароморфозы и идиоадаптации. Лабораторная работа
Ароморфозы и идиоадаптации. Лабораторная работа Электротовары. Виды
Электротовары. Виды Пластическая хирургия, СРС-1
Пластическая хирургия, СРС-1 Федеративна Республіка Німеччина
Федеративна Республіка Німеччина Układy analogowe. Wzmacniacz operacyjny
Układy analogowe. Wzmacniacz operacyjny Проект на тему: Воспитание организованности младших школьников средствами ИКТ-технологий
Проект на тему: Воспитание организованности младших школьников средствами ИКТ-технологий Коллективные творческие дела.
Коллективные творческие дела. Поздравление с Новым годом
Поздравление с Новым годом презентация Мой любимый Улан-Удэ викторина по истории города в форме своей игры
презентация Мой любимый Улан-Удэ викторина по истории города в форме своей игры Конструктор. Что мы знаем о нем? Виды детских конструкторов
Конструктор. Что мы знаем о нем? Виды детских конструкторов Понятие синдром Дауна
Понятие синдром Дауна Роль патохарактерологических и социальных факторов в развитии агрессивного и делинквентного поведения подростков
Роль патохарактерологических и социальных факторов в развитии агрессивного и делинквентного поведения подростков Основные дифференциальные различия речевой патологии от других нарушений развития
Основные дифференциальные различия речевой патологии от других нарушений развития Повышение уровня пенсионного обеспечения граждан
Повышение уровня пенсионного обеспечения граждан Презентация к классному часу Если хочешь быть здоров
Презентация к классному часу Если хочешь быть здоров Стрелочный перевод
Стрелочный перевод