Содержание
- 2. ЦЕЛИ УРОКА: 1) сформировать понятие об основаниях как электролитах; 2) рассмотреть классификацию оснований по различным признакам;
- 3. ЗАДАЧИ УРОКА: 1) учиться проводить химические реакции и записывать уравнения химических реакций в молекулярной, полной и
- 4. : Основания - это сложные вещества, в которых атом металла связан с одной или несколькими гидроксогруппами
- 5. Составить формулы оснований, образованных следующими металлами, и назвать их: 1) Cu (II) 2) Na 3) Cr
- 6. NaOH ↔ Na+ + OH– Ca(OH)2 ↔ Ca2+ +2OH– Ba(OH)2 ↔ Ba2+ +2OH– Диссоциация оснований
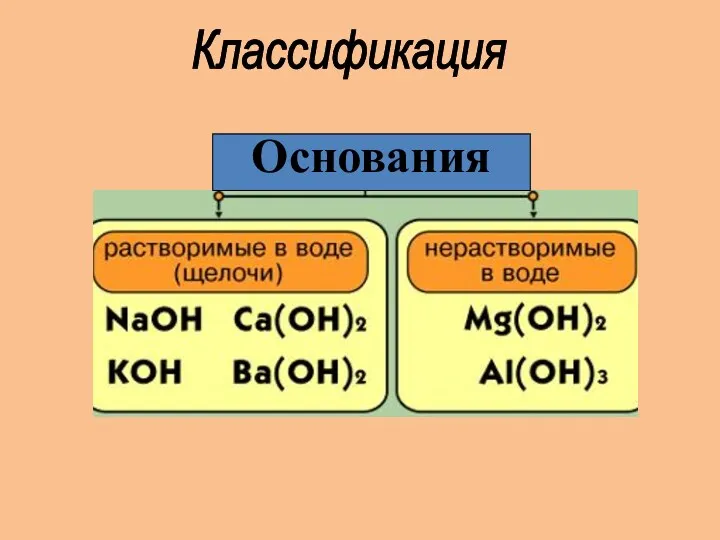
- 7. Классификация Основания
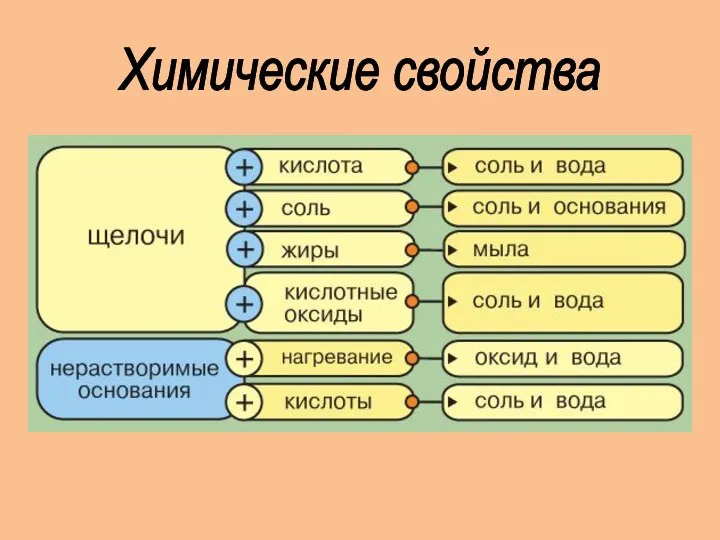
- 9. Химические свойства
- 10. ЗАПОМНИТЕ Основания ─ сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп. Гидроксогруппа ─
- 11. Вариант I Вариант II 1.Даны вещества: CaO; Al(OH)3; HCl; KOH; Na2SO4; MgO; Ba(OH)2; H2SO4; N2O5; NaOH;
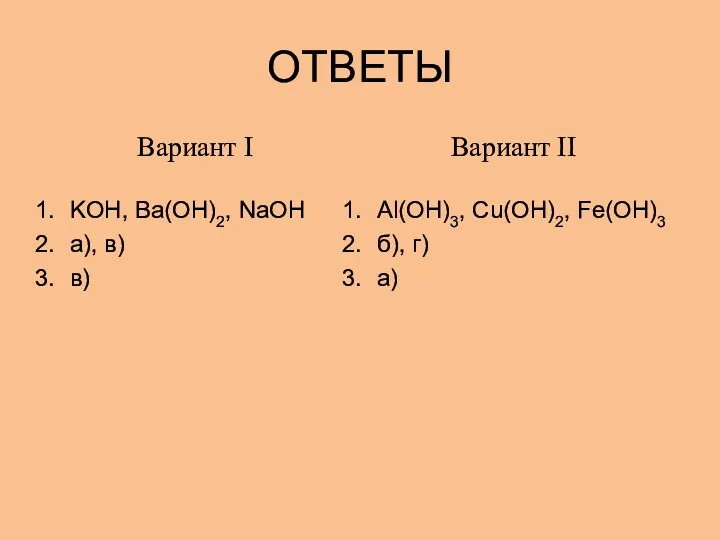
- 12. ОТВЕТЫ Вариант I KOH, Ba(OH)2, NaOH а), в) в) Вариант II Al(OH)3, Cu(OH)2, Fe(OH)3 б), г)
- 14. Скачать презентацию








 Презентации для уроков Истории и культуры Санкт-Петербурга
Презентации для уроков Истории и культуры Санкт-Петербурга Исламский мир
Исламский мир Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Физиология и биохимия растительной клетки. Вторичные метаболиты (вещества вторичного происхождения)
Физиология и биохимия растительной клетки. Вторичные метаболиты (вещества вторичного происхождения) Проектирование объектов строительства, строительные материалы и технология строительного производства. (Тема 3)
Проектирование объектов строительства, строительные материалы и технология строительного производства. (Тема 3) Магнітний запис інформації
Магнітний запис інформації Формы оздоровительно - развивающей работы с дошкольниками в условиях ФГТ
Формы оздоровительно - развивающей работы с дошкольниками в условиях ФГТ Многоканальный опыт
Многоканальный опыт Материалы по теме месяца
Материалы по теме месяца Публицистический стиль. Задания ЕГЭ
Публицистический стиль. Задания ЕГЭ Временные характеристики линейных стационарных автоматических систем
Временные характеристики линейных стационарных автоматических систем Презентация по теме: О вреде курения
Презентация по теме: О вреде курения Программа здоровьесбережения для школьников (презентация)
Программа здоровьесбережения для школьников (презентация) Федор Михайлович Достоевский
Федор Михайлович Достоевский Портфолио студентки Конькиной Полины Сергеевны. Колледж Петербургской моды
Портфолио студентки Конькиной Полины Сергеевны. Колледж Петербургской моды Шаблон презентации
Шаблон презентации Капитальный ремонт объекта Парк по пр. Ленинградскому от ул. Галушина до ул. Красной звезды
Капитальный ремонт объекта Парк по пр. Ленинградскому от ул. Галушина до ул. Красной звезды Система керування насосів цеху водопостачання з нечутливістю до змін гідравлічного опору мережі водоспоживання
Система керування насосів цеху водопостачання з нечутливістю до змін гідравлічного опору мережі водоспоживання Свобода в деятельности человека. (11 класс)
Свобода в деятельности человека. (11 класс) Консультация. Видоизменения корней
Консультация. Видоизменения корней Розробка режимів експлуатації ГНПС і прилеглої ділянки магістрального нафтопроводу
Розробка режимів експлуатації ГНПС і прилеглої ділянки магістрального нафтопроводу Сравнение окон ALT F50 и СИАЛ
Сравнение окон ALT F50 и СИАЛ Театральная студия
Театральная студия Религиозные символы народов России
Религиозные символы народов России Проповідь. Характеристики пояснювальної проповіді
Проповідь. Характеристики пояснювальної проповіді Долговые ценные бумаги. (Тема 4)
Долговые ценные бумаги. (Тема 4) Прямоугольник
Прямоугольник 20231017_igra_ege
20231017_igra_ege