Содержание
- 2. Щелочные металлы – элементы IA группы Перечислите известные вам щелочные металлы. Сколько электронов на внешнем энергетическом
- 3. Из истории открытия элементов 19 ноября 1907 года в Лондоне на заседании Королевского химического общества сэр
- 5. 3 января 1959 года В небе появилась комета. Необычная комета – искусственная: из летящей к Луне
- 6. Физические свойства Какое строение характерно для кристаллов щелочных металлов? Как изменяются температуры кипения и плавления? Какой
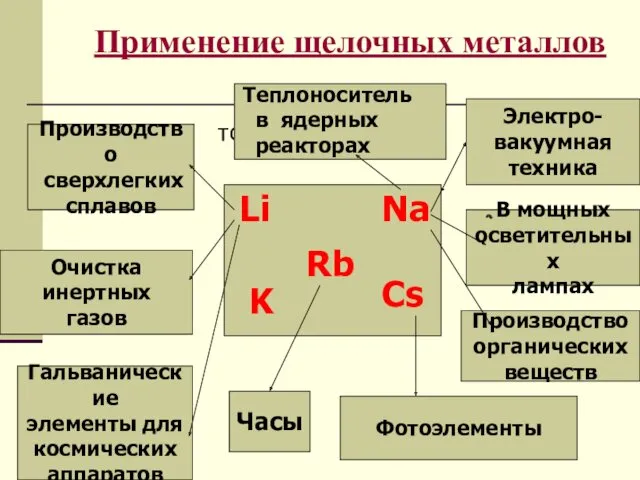
- 7. Применение щелочных металлов тото Электро- вакуумная техника В мощных осветительных лампах Производство органических веществ Производство сверхлегких
- 8. Соединения щелочных металлов В ветхом завете упоминается некое вещество «нетер». Это вещество употребляли как моющее средство.
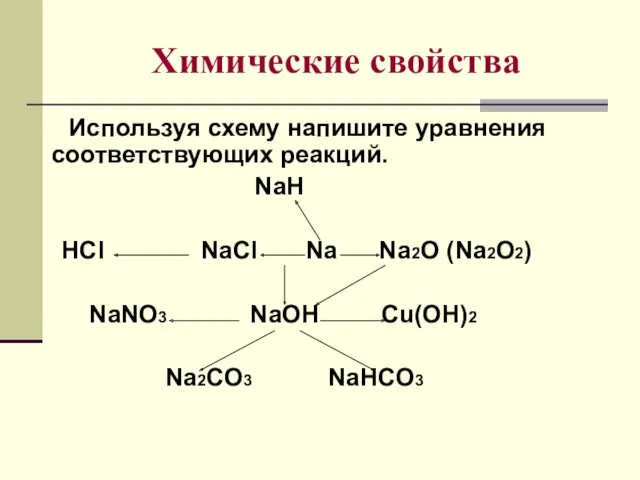
- 9. Химические свойства Используя схему напишите уравнения соответствующих реакций. NaH HCl NaCl Na Na2O (Na2O2) NaNO3 NaOH
- 10. Щелочноземельные металлы-элементы IIA группы Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция
- 11. Окраска пламени соединениями щелочных и щелочноземельных металлов
- 12. Кальций –типичный представитель щелочноземельных металлов Дайте названия соединениям кальция: CaO Ca(OH)2 CaCO3 CaHCO3 Вспомните тривиальные названия
- 13. Жесткость воды
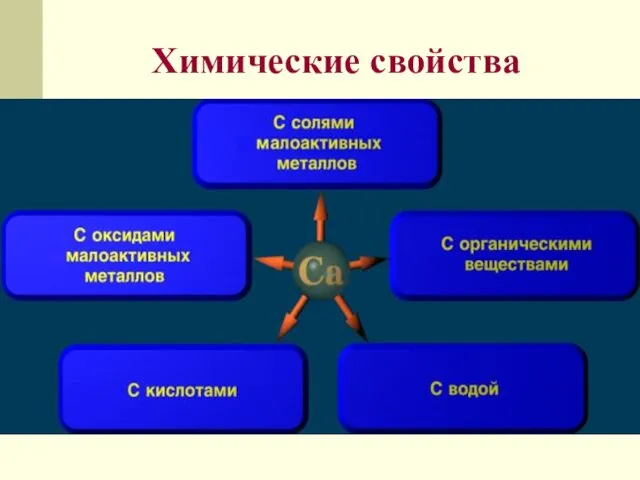
- 14. Химические свойства
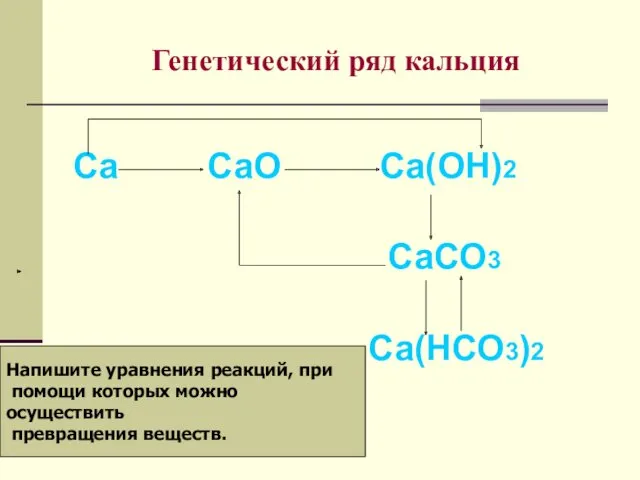
- 15. Генетический ряд кальция Са СаО Са(ОН)2 СаСО3 Са(НСО3)2 Напишите уравнения реакций, при помощи которых можно осуществить
- 16. Кальций в природе Кальциевые горные породы – известняк, мрамор, мел. Вспомните формулу этих горных пород. В
- 17. Мел, известняк, мрамор не растворяются в чистой воде, но растворимы в кислых растворах, даже таких слабых,
- 18. Как называются отложения, свисающие в виде гигантских сосулек со свода пещеры? А растущие навстречу им со
- 19. При воздействии кислотных дождей строения разрушаются. Какие реакции при этом происходят? Известняк и мрамор используют в
- 20. ? ? ? Каково значение щелочных и щелочно-земельных металлов в жизни человека? Как изменяются свойства оксидов
- 22. Скачать презентацию















 Законодавче забезпечення обліку об’єктів нерухомості
Законодавче забезпечення обліку об’єктів нерухомості Презентация к модулю 3
Презентация к модулю 3 Педагогический проект Развитие творческой активности личности в хореографическом коллективе
Педагогический проект Развитие творческой активности личности в хореографическом коллективе Агропромышленный комплекс России
Агропромышленный комплекс России ДЕНЬ НАРОДНОГО ЕДИНСТВА
ДЕНЬ НАРОДНОГО ЕДИНСТВА Арабский халифат
Арабский халифат Империя Наполеона. Урок 9
Империя Наполеона. Урок 9 Индивидуальные инвестиционные счета: понятие, особенности, налоговые льготы
Индивидуальные инвестиционные счета: понятие, особенности, налоговые льготы Виды дислексии у умственно отсталых школьников
Виды дислексии у умственно отсталых школьников Правила поведения в гостях.
Правила поведения в гостях. Василий Андреевич Жуковский (1783-1852)
Василий Андреевич Жуковский (1783-1852) Жизнь на разных материках
Жизнь на разных материках Социальный туризм. Приозерск - Старая Ладога
Социальный туризм. Приозерск - Старая Ладога Тренды 2018
Тренды 2018 Презентация по теме: Игры и игровые технологии на уроках в коррекционной школе-интернате, применяемые в работе с детьми с ограниченными возможностями здоровья (из опыта работы)..
Презентация по теме: Игры и игровые технологии на уроках в коррекционной школе-интернате, применяемые в работе с детьми с ограниченными возможностями здоровья (из опыта работы).. Великая Отечественная война.
Великая Отечественная война. Назначение судовой котлотурбинной установки
Назначение судовой котлотурбинной установки История башмачной артели в д.Ермолино.Творческий проект учащихся 6 класса.
История башмачной артели в д.Ермолино.Творческий проект учащихся 6 класса. Толерантность.
Толерантность. (ДЛЯ ПЕДАГОГОВ) музыкальные уголки в группах
(ДЛЯ ПЕДАГОГОВ) музыкальные уголки в группах Абсолютное и сравнительное преимущество в международной торговле. Протекционизм. цели и средства. Импортные тарифы
Абсолютное и сравнительное преимущество в международной торговле. Протекционизм. цели и средства. Импортные тарифы Чемпионский Спартак
Чемпионский Спартак Текстильная промышленность
Текстильная промышленность Реновация: понятие и использование в зарубежной градостроительной практике
Реновация: понятие и использование в зарубежной градостроительной практике Презентация Амуляев
Презентация Амуляев Множественное число в английском языке
Множественное число в английском языке Професія – інспектор рибоохоронного патруля
Професія – інспектор рибоохоронного патруля Специальные распределения. χ2 -распределение
Специальные распределения. χ2 -распределение