методическая разработка урока по теме Щелочные металлы для 9 класса (автор учебника О.С.Габриелян) презентация
Содержание
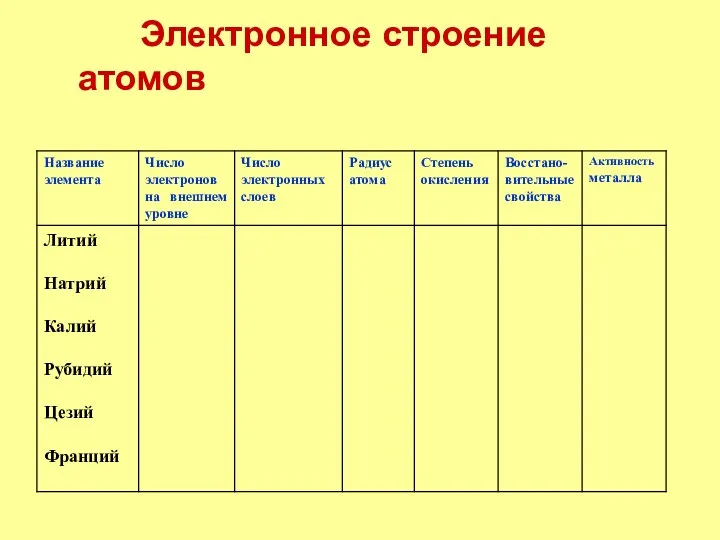
- 2. План 1. Щелочные металлы – элементы 1.Положение в ПСХЭ; 2.Строение атомов. 2. Щелочные металлы – простые
- 3. Электронное строение атомов
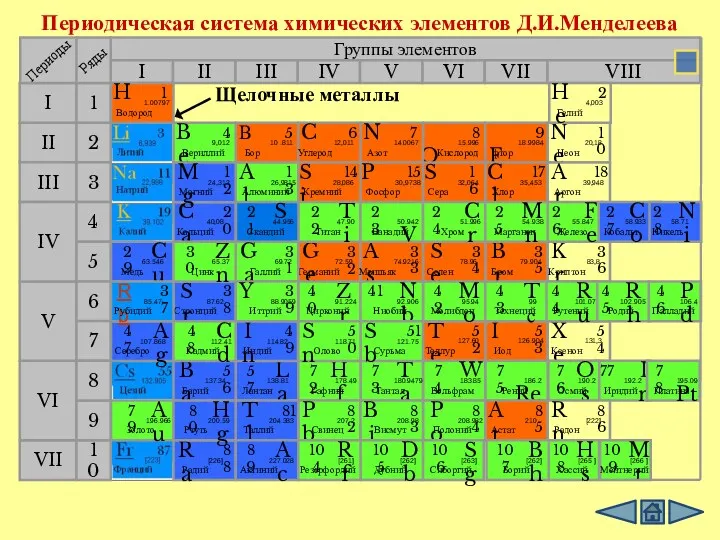
- 4. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
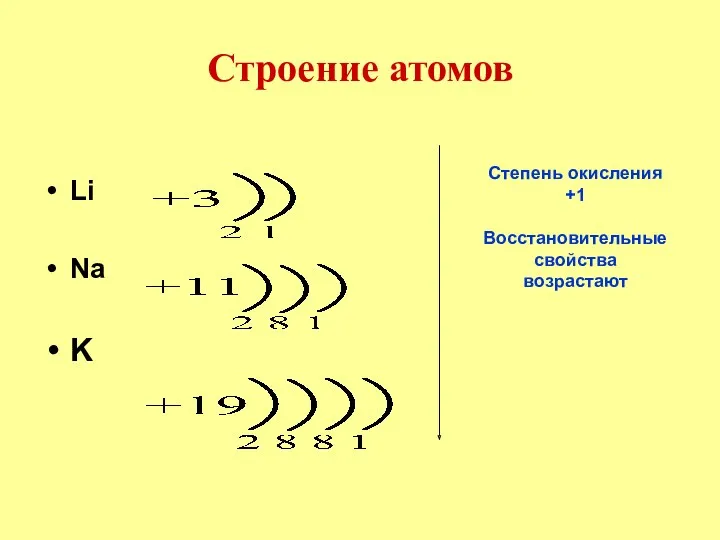
- 5. Строение атомов Li Na K Степень окисления +1 Восстановительные свойства возрастают
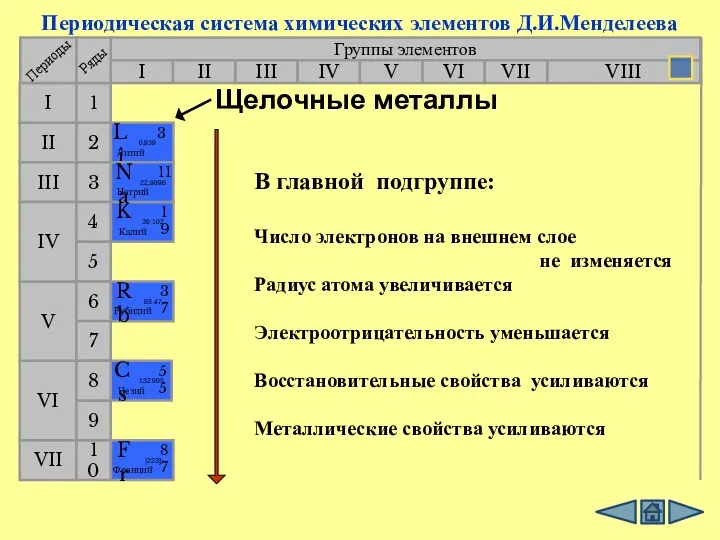
- 6. Li Na K Rb Cs Fr Увеличивается химическая активность, так как увеличивается радиус атомов(количество электронных уровней)
- 7. Группы элементов I III II VIII IV V VI VII II I III VII VI V
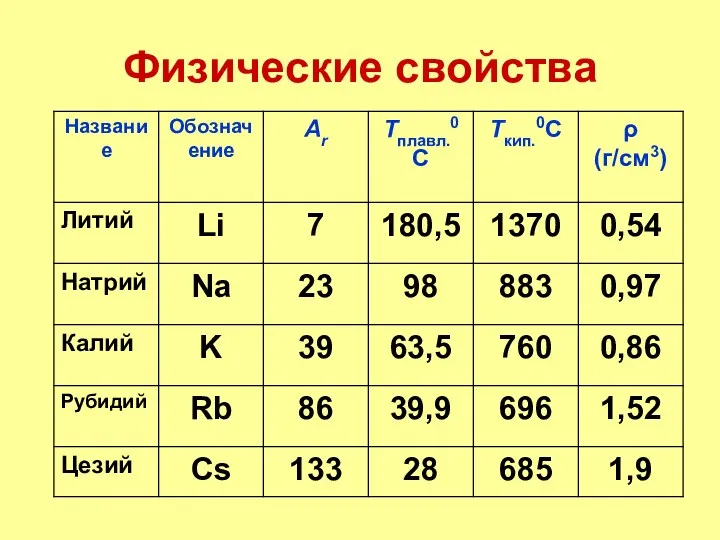
- 8. Физические свойства
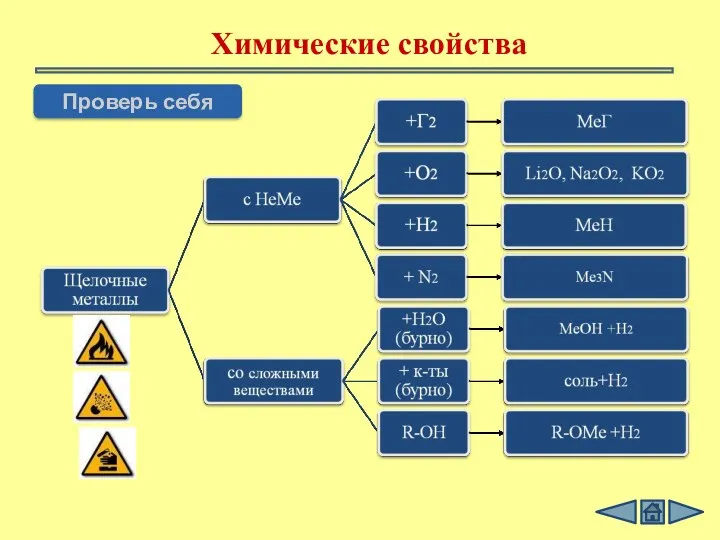
- 9. Взаимодействие с простыми веществами С кислородом Li + O2 = Na + O2 = С галогенами
- 10. Взаимодействие с простыми веществами С кислородом 4Li + O2 = 2Li 2 оксид 2Na + O2
- 11. Химические свойства щелочных металлов С водой 2Na + 2H2O = 2NaOH + H2↑ щелочь
- 12. Химические свойства Проверь себя
- 13. Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое
- 15. Скачать презентацию






 Конференция
Конференция Рынок ценных бумаг
Рынок ценных бумаг Кома жағдайлардың ажырату диагностикасы
Кома жағдайлардың ажырату диагностикасы Food idioms
Food idioms OVB Event
OVB Event Внеклассное мероприятие В гостях у её Величества - королевы Электричества
Внеклассное мероприятие В гостях у её Величества - королевы Электричества Паллиативный сестринский уход при кожных проявлениях. Основные подходы к терапии болевого синдрома. №5
Паллиативный сестринский уход при кожных проявлениях. Основные подходы к терапии болевого синдрома. №5 2615Імунофлуорисцентний експрес аналізатор LS-1100
2615Імунофлуорисцентний експрес аналізатор LS-1100 Конденсационные устройства турбин
Конденсационные устройства турбин Родительское собрание первый раз в первый класс
Родительское собрание первый раз в первый класс Иудейская культура: история и современность. Тема 7
Иудейская культура: история и современность. Тема 7 Храмы Крыма и их история
Храмы Крыма и их история Мастер-класс Оригами для дошкольников в условиях внедрения ФГОС ДО (презентация+текст)
Мастер-класс Оригами для дошкольников в условиях внедрения ФГОС ДО (презентация+текст) Ядро хромосомы. Жизненный цикл клеток. Деление клеток
Ядро хромосомы. Жизненный цикл клеток. Деление клеток Шаблон Фракталы-19
Шаблон Фракталы-19 Исследовательская работа Ядовитые комнатные растения и их влияние на живые организмы
Исследовательская работа Ядовитые комнатные растения и их влияние на живые организмы Каждой пичужке кормушка
Каждой пичужке кормушка Доброе дело
Доброе дело Шитикова В.А
Шитикова В.А Разработка реестра ветеранов шахтерского труда с использованием языка веб-программирования PHP и базы данных MySQL
Разработка реестра ветеранов шахтерского труда с использованием языка веб-программирования PHP и базы данных MySQL Социальное партнерство школы с различными структурами
Социальное партнерство школы с различными структурами Искусство. Человек и общество
Искусство. Человек и общество Профилактика суицидальных тенденций среди несовершеннолетних в условиях урочной и внеурочной деятельности
Профилактика суицидальных тенденций среди несовершеннолетних в условиях урочной и внеурочной деятельности Общение в сети Интернет
Общение в сети Интернет Диагностический материал для обследования фонематического восприятия у дошкольников.Слова-паронимы Диск
Диагностический материал для обследования фонематического восприятия у дошкольников.Слова-паронимы Диск Банкет с частичным обслуживанием
Банкет с частичным обслуживанием Презентация Мы помним, мы гордимся!
Презентация Мы помним, мы гордимся! Отчет о финансовых результатах и бухгалтерские процедуры по его составлению
Отчет о финансовых результатах и бухгалтерские процедуры по его составлению