Содержание
- 2. …это проникновение в атмосферный воздух новых нехарактерных для него физических, химических и биологических веществ или изменение
- 3. Основные загрязнители атмосферного воздуха: Оксид углерода Оксиды азота Диоксид серы Углеводороды Альдегиды Тяжёлые металлы Аммиак
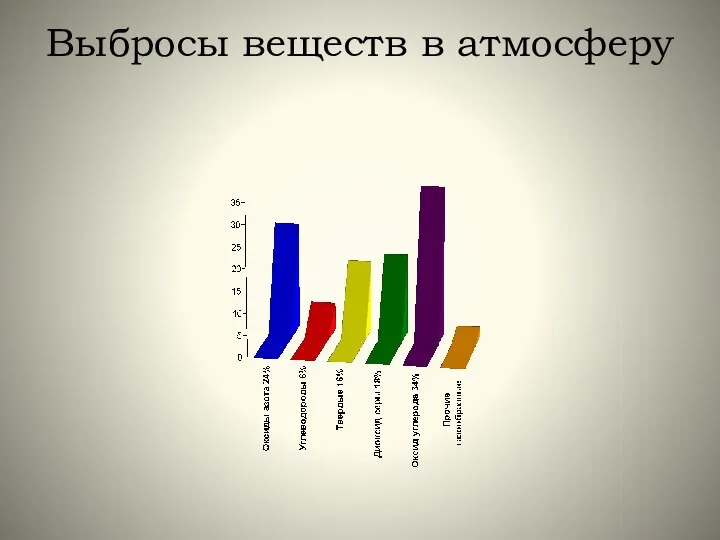
- 4. Выбросы веществ в атмосферу
- 5. ЗАКОН «О ЧИСТОМ ВОЗДУХЕ» ЗАКОН «О ЧИСТОМ ВОЗДУХЕ»
- 6. Последствия загрязнения атмосферы. Смог Смог-это туман, смешанный с пылью, сажей и ядовитыми газами. Смог оказывает влияние
- 8. Что такое угарный газ? Угарный газ (оксид углерода (II) — бесцветный ядовитый газ без вкуса и
- 9. Пирометаллургия - получение металлов и сплавов под действием высоких температур. Восстановление металлов угарным газом: PbO +
- 10. Физиологическое действие угарного газа на организм. Угарный газ очень ядовит. Первыми признаками острого отравления СО являются
- 11. Оксид углерода (IV) Углекислый газ Газ без цвета и запаха. Это кислотный оксид, ему соответствует двухосновная
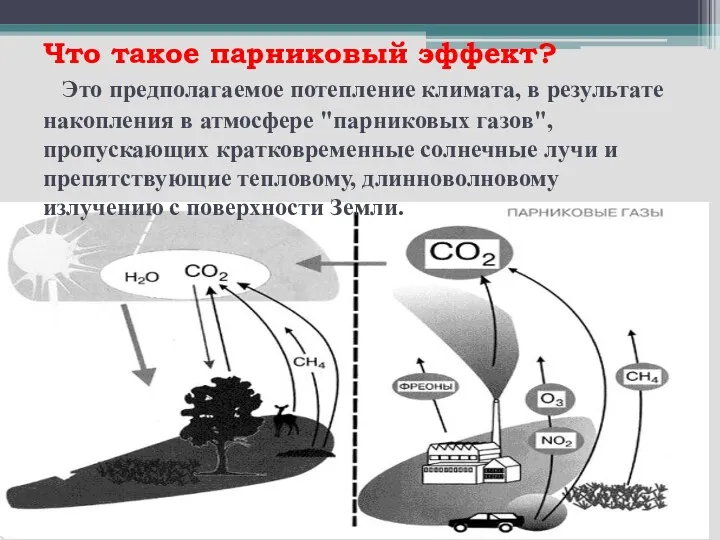
- 12. Что такое парниковый эффект? Это предполагаемое потепление климата, в результате накопления в атмосфере "парниковых газов", пропускающих
- 13. Применение углекислого газа
- 14. SO2 оксид серы(IV) Сернистый газ Физические свойства SO2 Химические свойства SO2 Кислотный оксид Обладает всеми свойствами
- 15. . Кислотные дожди Любая дождевая вода обладает очень слабой степенью кислотности. Однако при сгорании продуктов переработки
- 16. до после
- 17. Оксид азота (II) NO Бесцветный газ, не имеет запаха. В воде малорастворим. Образуется из азота и
- 18. Оксид азота (IV)- NO2 Кислотный оксид 2NO2 + H2O = HNO2 + HNO3 Ядовитый газ бурого
- 19. Применение азотной кислоты: - производство азотных и комбинированных удобрений, - взрывчатых веществ (тринитротолуола и др.), -
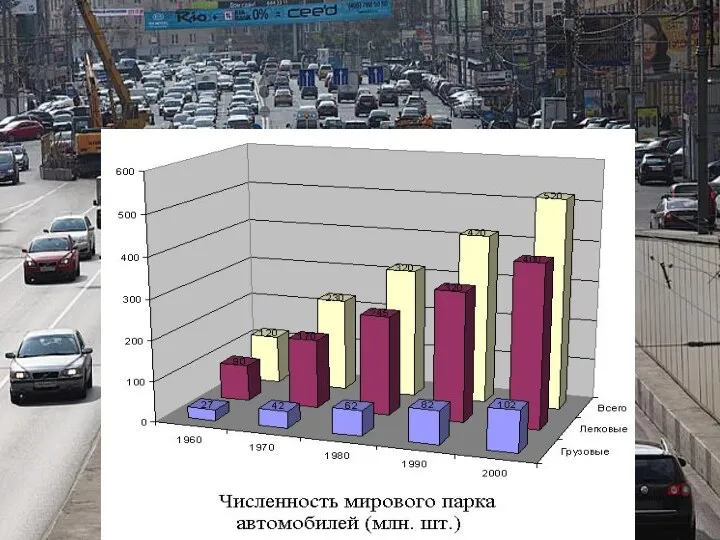
- 21. Меры по охране атмосферы от загрязнения: Разработать стандарты по выхлопным газам для автомобилей. Прекратить вырубку лесов.
- 23. Скачать презентацию

















 Academic Language for English Language Learners
Academic Language for English Language Learners Аппликация Барашек.
Аппликация Барашек. Мифтахова Л.М., Презентация 28.01.2022г
Мифтахова Л.М., Презентация 28.01.2022г Видеосъемка свадьбы от операторов снявших свадьбу Юлии Савичевой
Видеосъемка свадьбы от операторов снявших свадьбу Юлии Савичевой географические загадки география 6 класс
географические загадки география 6 класс Психология конфликтного взаимодействия
Психология конфликтного взаимодействия Агния Барто детская поэтесса
Агния Барто детская поэтесса мой мир и я
мой мир и я Презентация к стереометрии. Куб
Презентация к стереометрии. Куб Виды сталей и их термическая обработка для изготовления изделий
Виды сталей и их термическая обработка для изготовления изделий Какой он мир, где мне тепло
Какой он мир, где мне тепло Трудовое воспитание дошкольников.
Трудовое воспитание дошкольников. Низшие беспозвоночные
Низшие беспозвоночные Использование динамической памяти
Использование динамической памяти Студенческая субкультура
Студенческая субкультура Химическая связь. Строение вещества.
Химическая связь. Строение вещества. Посвящаю тебе мой Родной
Посвящаю тебе мой Родной Тимуровская работа
Тимуровская работа Детская игрушка!
Детская игрушка! Богдинско-Баскунчакский заповедник
Богдинско-Баскунчакский заповедник Работа с детьми раннего возраста в период адаптации
Работа с детьми раннего возраста в период адаптации Женская самоуверенность
Женская самоуверенность Портфолио воспитателя
Портфолио воспитателя Разнообразие природы Земли
Разнообразие природы Земли Начало Реформации в Европе
Начало Реформации в Европе Гоголь
Гоголь Контроль качества предстерилизационной очистки
Контроль качества предстерилизационной очистки СЮЖЕТНО – РОЛЕВАЯ ИГРА КАК СРЕДСТВО ФОРМИРОВАНИЯ МЕЖЛИЧНОСТЫХ ОТНОШЕНИЙ СО СВЕРСТНИКАМИ В СООТВЕТСТВИИ С ФГОС ДО
СЮЖЕТНО – РОЛЕВАЯ ИГРА КАК СРЕДСТВО ФОРМИРОВАНИЯ МЕЖЛИЧНОСТЫХ ОТНОШЕНИЙ СО СВЕРСТНИКАМИ В СООТВЕТСТВИИ С ФГОС ДО