Содержание
- 2. В настоящее время в российской производственной практике используются следующие основные системы обеспечения качества и безопасности пищевой
- 3. Стандарт GMP (англ. Good Manufacturing Practice; Надлежащая производственная практика) – правила, которые устанавливают требования к организации
- 4. История GMP Впервые правила GMP были сформулированы в Соединённых Штатах Америки в 1963 году. В 1967
- 5. GMP GLP (Надлежащая лабораторная практика) GCP (Надлежащая клиническая практика) GPvP (Надлежащая практика фармаконадзора) GACP (Надлежащая практика
- 6. GMP в РФ и ЕАЭС В 2016 году решением Совета Евразийской Экономической Комиссии от 03.11.2016 г.
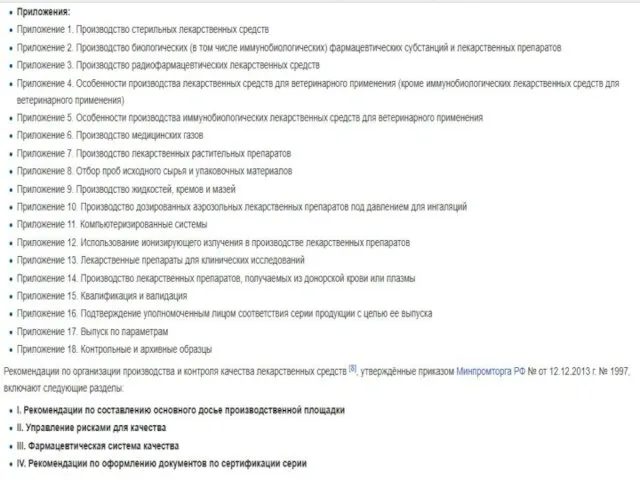
- 7. Правила надлежащей производственной практики, утвержденные приказом Министерства промышленности и торговли РФ от 14.06.2013 г. № 916
- 9. Надлежащая практика GMP Согласно определению, предложенному ВОЗ, под надлежащей практикой (организации) производства (GMP) подразумевается «тот объем
- 10. Внедрению системы GMP на предприятиях пищевой промышленности способствовало развитие сегмента производства детского и специализированного питания, пищевых
- 11. Правила GMP касаются всех аспектов процесса производства, включая следующее: заданный производственный процесс; описание всех технологических процессов
- 12. Руководящий принцип GMP состоит в том, что качество закладывается в процесс выпуска продукции, а не только
- 13. По сути, GMP – это совокупность ряда российских ГОСТов и СНиПов. Однако, есть в этом перечне
- 14. Для предприятий GMP+ определяет основные требования к каждому производственному процессу — начиная от используемых для строительства
- 15. Таким образом, GMP+ - это нормы и правила, обеспечивающие надлежащий контроль качества на тех предприятиях, основной
- 16. Но на этом процесс проверки не заканчивается — для проведения конечного анализа берут по одному экземпляру
- 17. Особые требования предъявляет стандарт качества GMP+ к производственным помещениям — обязательно должны контролироваться параметры влажности и
- 19. Область применения: Настоящий стандарт распространяется на биологически активные добавки к пище и устанавливает требования к их
- 24. Скачать презентацию



















 Влияние сотовых телефонов на здоровье человека
Влияние сотовых телефонов на здоровье человека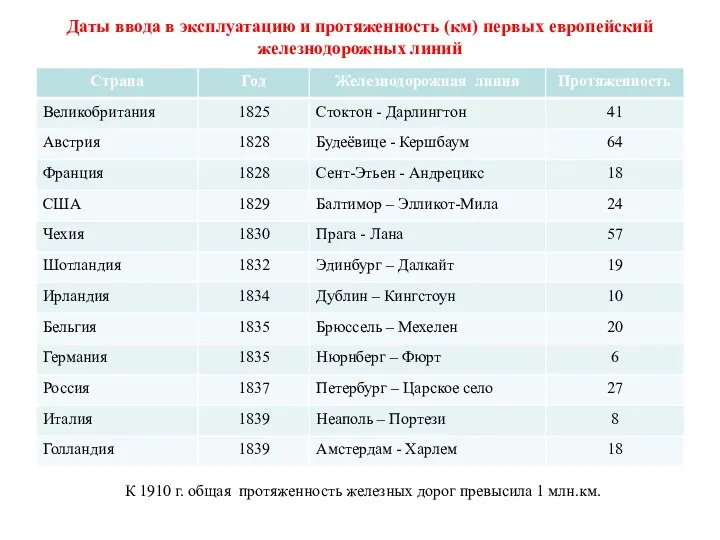 Даты ввода в эксплуатацию и протяженность (км) первых европейский железнодорожных линий
Даты ввода в эксплуатацию и протяженность (км) первых европейский железнодорожных линий ТРИЗ Мир человека 2 класс
ТРИЗ Мир человека 2 класс Физиология пищеварения
Физиология пищеварения Экспериментирование в детском саду
Экспериментирование в детском саду Вещество. Состояние вещества. Кристаллические решётки
Вещество. Состояние вещества. Кристаллические решётки Modern and efficient public transport system
Modern and efficient public transport system Симптомы патологии дыхательной системы
Симптомы патологии дыхательной системы Изображение пространственных фигур на плоскости
Изображение пространственных фигур на плоскости Әлифба дәреслере.б,в,г хәрефләре
Әлифба дәреслере.б,в,г хәрефләре The Grounds For Judicial Review
The Grounds For Judicial Review Химия биогенных элементов (часть 1)
Химия биогенных элементов (часть 1) презентация австралия
презентация австралия Техническая эксплуатация подвижного состава железных дорог
Техническая эксплуатация подвижного состава железных дорог Любовь и дружба с героями книг Лидии Чарской
Любовь и дружба с героями книг Лидии Чарской Возведение зданий с металлическим каркасом
Возведение зданий с металлическим каркасом Таланты Богородского края.
Таланты Богородского края.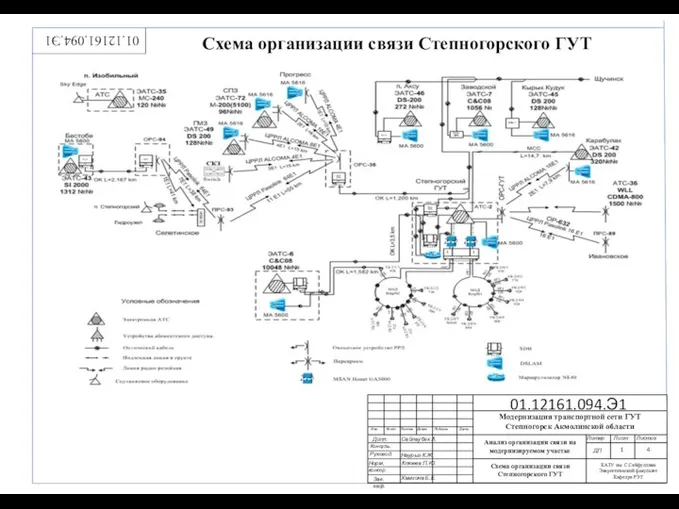 Схема организации связи Степногорского ГУТ
Схема организации связи Степногорского ГУТ Человек на фотографии. Операторское мастерство фотопортрета
Человек на фотографии. Операторское мастерство фотопортрета Режиссёрская игра.
Режиссёрская игра. Оператор множественного выбора CASE
Оператор множественного выбора CASE Структурная схема, принцип работы и параметры импульсного блока питания
Структурная схема, принцип работы и параметры импульсного блока питания Смешанные числа
Смешанные числа Composition restaurant premises
Composition restaurant premises Новогодний эрудит
Новогодний эрудит Презентация Природные зоны Африки
Презентация Природные зоны Африки Сочинение-описание картины И. Э. Грабаря Февральская лазурь
Сочинение-описание картины И. Э. Грабаря Февральская лазурь Технология проблемного диалога
Технология проблемного диалога