Содержание
- 2. Амедео Авогадро, итальянский физик, открыл закон в 1811 г n
- 3. Задание: вычислить М(Н2О) = М(NaCL) = М(Zn) =
- 4. Проверка М(Н2О) = 2Ar (H) + Ar (O) = 2x1 + 16 = 18 г/моль М(NaCL)
- 5. Молярный объем газа – это отношение объема газа к количеству вещества: V Vm = — n
- 6. Тема урока: Молярный объем газов Следствие из закона Авогадро
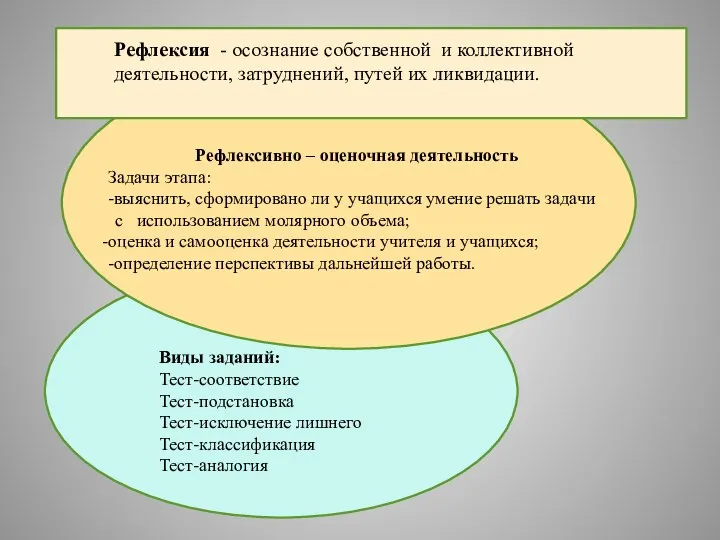
- 7. Рефлексия - осознание собственной и коллективной деятельности, затруднений, путей их ликвидации. Рефлексивно – оценочная деятельность Задачи
- 8. Шаблон для проверки выполненных на уроке заданий да нет Фамилия, имя______________________ Задание 1 Задача 2 Задача
- 10. Скачать презентацию






 Пластикалық материалдардан бұйым жасау технологиясы
Пластикалық материалдардан бұйым жасау технологиясы Повышение качества знаний учащихся через развитие познавательного интереса на уроках математики.
Повышение качества знаний учащихся через развитие познавательного интереса на уроках математики. Реки России
Реки России Куда текут реки?
Куда текут реки? Формы и виды публичной коммуникации
Формы и виды публичной коммуникации День народного единения
День народного единения Чипинкос и Дядя J.i.d
Чипинкос и Дядя J.i.d 20230724_interes_k_fzk
20230724_interes_k_fzk 210 лет со дня рождения Н.В. Гоголя. Дело, взятое из души…. Выставка-презентация
210 лет со дня рождения Н.В. Гоголя. Дело, взятое из души…. Выставка-презентация презентация-викторина, посвященная 100-летию в 1-ой мировой войне
презентация-викторина, посвященная 100-летию в 1-ой мировой войне Показатели психического развития здоровых детей и детей с ЗПР в возрасте 4 лет
Показатели психического развития здоровых детей и детей с ЗПР в возрасте 4 лет Крайние точки России
Крайние точки России Түбір өзектерді аспатармен өңдеу әдістері (Step Back, Crown Down, теңестірілген күш әдісі). Түбір өзектерді аспаптармен
Түбір өзектерді аспатармен өңдеу әдістері (Step Back, Crown Down, теңестірілген күш әдісі). Түбір өзектерді аспаптармен Повышение качества цементирования. (Лекция 4)
Повышение качества цементирования. (Лекция 4) Рабочие профессии Кузбасса. 9 класс
Рабочие профессии Кузбасса. 9 класс She/from. He/from
She/from. He/from Россия – многонациональное государство
Россия – многонациональное государство Meine sommerferien
Meine sommerferien Description of pictures
Description of pictures Скандинавская правовая семья
Скандинавская правовая семья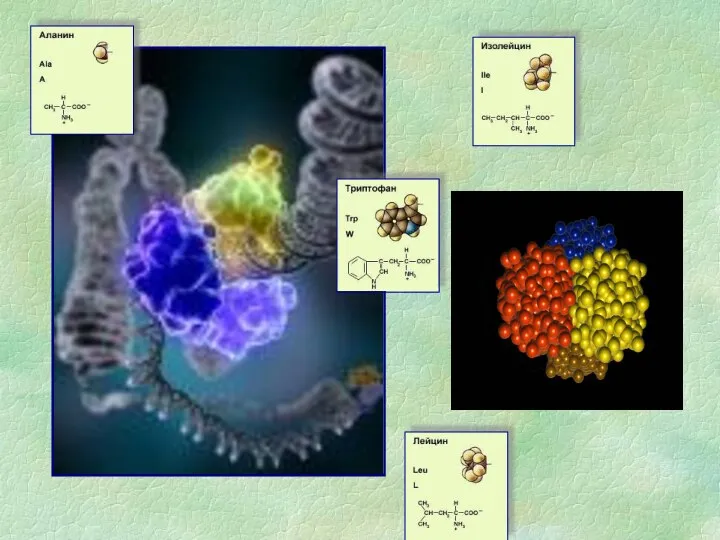 презентация НУКЛЕИНОВЫЕ КИСЛОТЫ
презентация НУКЛЕИНОВЫЕ КИСЛОТЫ Наукова революцiя Нового часу. Формування засад класичної науки
Наукова революцiя Нового часу. Формування засад класичної науки Основные виды PR-мероприятий
Основные виды PR-мероприятий Схема территориального размещения участников промышленного кластера
Схема территориального размещения участников промышленного кластера Методические рекомендации по внеурочной деятельности
Методические рекомендации по внеурочной деятельности Дислалия .Система коррекционной работы
Дислалия .Система коррекционной работы Сметные цены в строительстве
Сметные цены в строительстве Региональная экономика. Природно-ресурсный потенциал
Региональная экономика. Природно-ресурсный потенциал