Содержание
- 2. 1й закон: Δm =kq (при I= const: Δm = kIt) (1), где k – ЭХ эквивалент
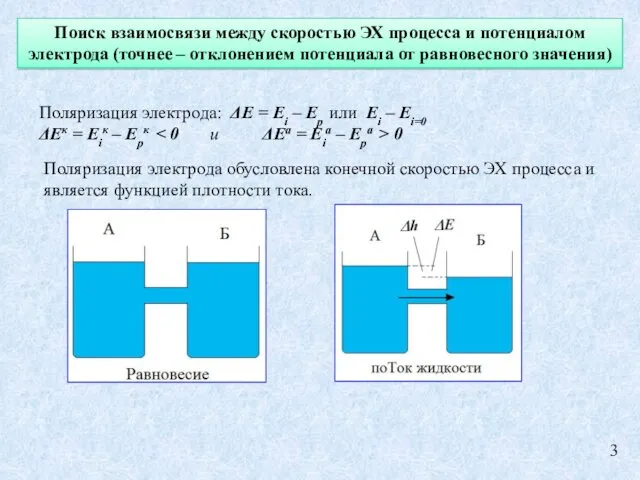
- 3. Поиск взаимосвязи между скоростью ЭХ процесса и потенциалом электрода (точнее – отклонением потенциала от равновесного значения)
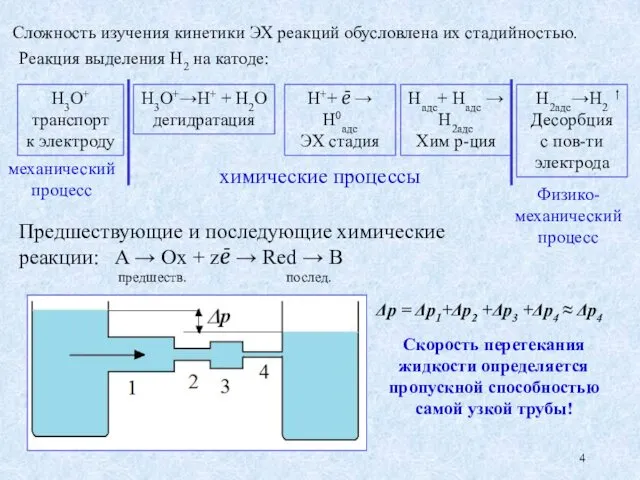
- 4. Реакция выделения Н2 на катоде: Н3О+ транспорт к электроду Н3О+→Н+ + Н2О дегидратация Н++ ē →
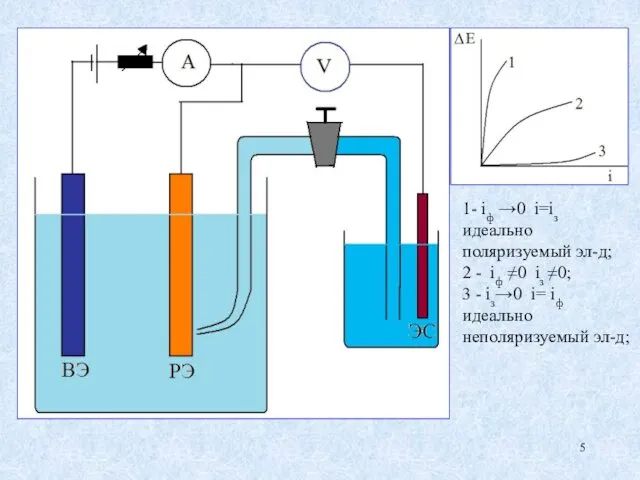
- 5. 1- iф →0 i=iз идеально поляризуемый эл-д; 2 - iф ≠0 iз ≠0; 3 - iз→0
- 6. Уравнения диффузионной кинетики Поток диффузии: (1) , где D – коэф. диффузии. Ур-е (1) – 1й
- 7. (4’) [ Ox + nē ↔ Red ] или - второе основное ур-е диффузионной кинетики. Для
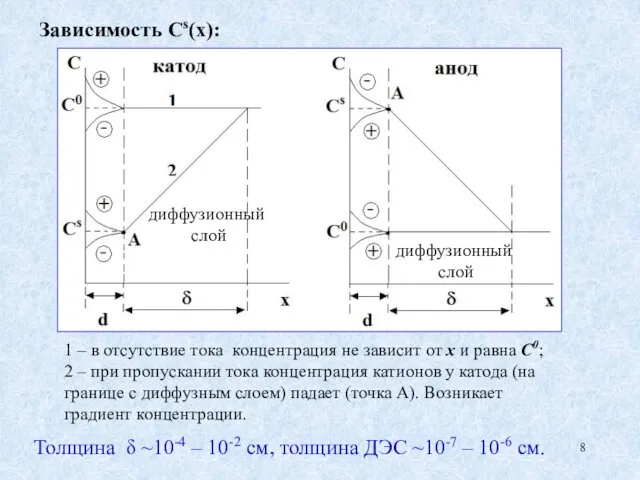
- 8. Зависимость Сs(х): 1 – в отсутствие тока концентрация не зависит от х и равна C0; 2
- 9. Чтобы найти зависимость Сs(х), необходимо решить уравнение 2го з-на Фика: (6) (≡3е основное уравнение диффузионной кинетики)
- 10. Теория Нернста-Бруннера для твердого электрода 4 основных положения (допущения) теории – см. лекцию Ячейка для реализации
- 11. (3) Из уравнения (3) следует, что iкат может расти до некоторого предельного значения (при CS→ 0).
- 12. Уравнение ПОЛЯРИЗАЦИОННОЙ КРИВОЙ В УСЛОВИЯХ ЗАМЕДЛЕННОЙ СТАЦИОНАРНОЙ ДИФФУЗИИ (6) можно преобразовать, возведя число e в степень,
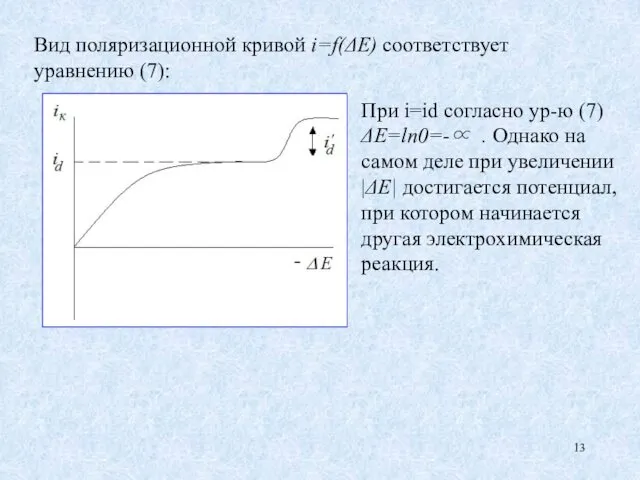
- 13. Вид поляризационной кривой i=f(ΔE) соответствует уравнению (7): При i=id согласно ур-ю (7) ΔE=ln0=-∝ . Однако на
- 14. Уточнение для случая, когда катодный ток складывается из тока диффузии и тока миграции: iк = iдиф
- 15. В случае образования на аноде хорошо растворимой и хорошо диссоциирующей соли предельного тока нет. При образовании
- 16. 4. При добавлении индифферентного электролита его влияние зависит от природы разряжающейся частицы: А) на катоде разряжаются
- 18. Скачать презентацию


![(4’) [ Ox + nē ↔ Red ] или -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/83127/slide-6.jpg)







 Процесс передачи информации. 7 класс
Процесс передачи информации. 7 класс Обработка информации
Обработка информации Көже дайындау процесі
Көже дайындау процесі Вплив світла і температури на рослини
Вплив світла і температури на рослини Изменения в ОСАГО 2019
Изменения в ОСАГО 2019 Беременность и заболевания сердечно-сосудистой системы
Беременность и заболевания сердечно-сосудистой системы Як бачать тварини
Як бачать тварини Динамические оттенки в музыке
Динамические оттенки в музыке Загальний огляд змін у законодавстві щодо захисту прав споживачів
Загальний огляд змін у законодавстві щодо захисту прав споживачів Электроэнергетика мира и России
Электроэнергетика мира и России Наказание и поощрение в воспитании ребёнка
Наказание и поощрение в воспитании ребёнка Развитие мелкой моторики у детей от 1 года до 3 лет
Развитие мелкой моторики у детей от 1 года до 3 лет РОДИТЕЛЬСКОЕ СОБРАНИЕ В ЧЕМ НАШИ ОШИБКИ
РОДИТЕЛЬСКОЕ СОБРАНИЕ В ЧЕМ НАШИ ОШИБКИ Патологияның негізі ретіндегі тұқым қуалаушы белгілердің өзгергіштігі
Патологияның негізі ретіндегі тұқым қуалаушы белгілердің өзгергіштігі Методы управления компании Microsoft
Методы управления компании Microsoft Упрощение и оптимизация логических схем. (Лекция 3)
Упрощение и оптимизация логических схем. (Лекция 3) Антиоксидантный комплекс витаминов Новомин. Сибирское здоровье
Антиоксидантный комплекс витаминов Новомин. Сибирское здоровье Бытовые приборы для уборки и создания микроклимата помещений
Бытовые приборы для уборки и создания микроклимата помещений Годы зрелости 1830-1854
Годы зрелости 1830-1854 Из истории с.Преполовенка
Из истории с.Преполовенка Антигистаминные средства
Антигистаминные средства Политическая карта мира
Политическая карта мира Эпидемиология и профилактика сибирской язвы
Эпидемиология и профилактика сибирской язвы Викторина по литературному чтению
Викторина по литературному чтению Классный час в 5 классе по теме: Что мы должны знать о ПАВ
Классный час в 5 классе по теме: Что мы должны знать о ПАВ Малышам о безопасности Диск
Малышам о безопасности Диск Презентация Звуки и буквы
Презентация Звуки и буквы Вторая волна научной революции 60-90-х годов ХХ века. Синергетика
Вторая волна научной революции 60-90-х годов ХХ века. Синергетика