Содержание
- 2. Алкены (этиленовые углеводороды) Это углеводороды, с общей формулой CnH2n, содержащие в молекуле одну двойную связь. С2Н4
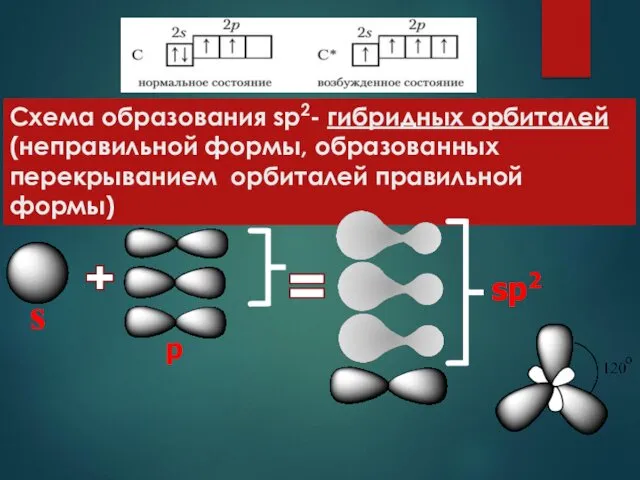
- 3. Схема образования sp2- гибридных орбиталей (неправильной формы, образованных перекрыванием орбиталей правильной формы) s p sp2
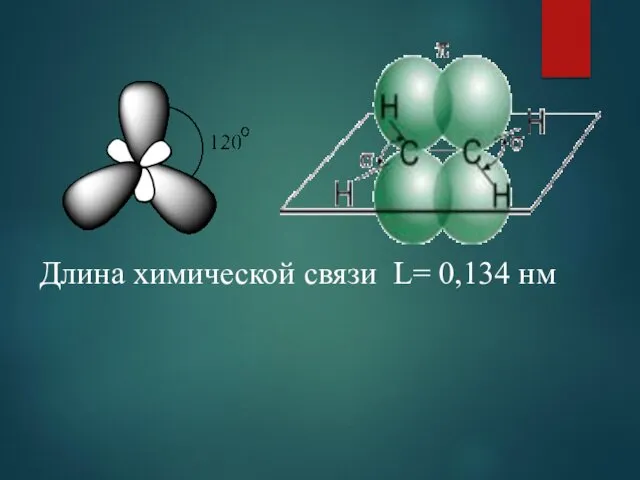
- 4. Длина химической связи L= 0,134 нм
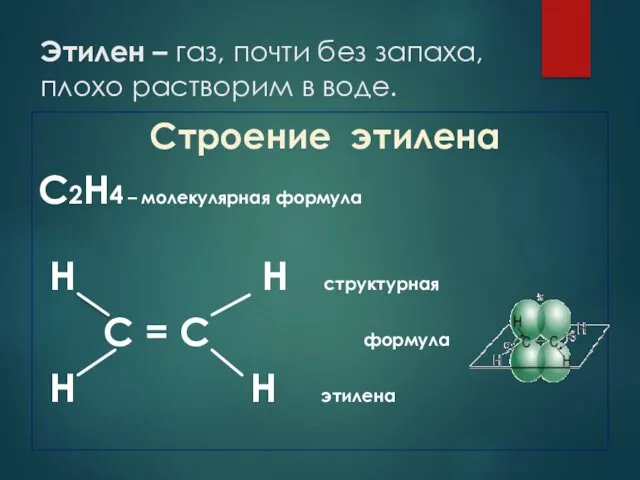
- 5. Этилен – газ, почти без запаха, плохо растворим в воде. Строение этилена С2Н4 – молекулярная формула
- 6. Изомерия алкенов 1) углеродного скелета CH2 = CH – CH2 – CH3 CH2 = C –
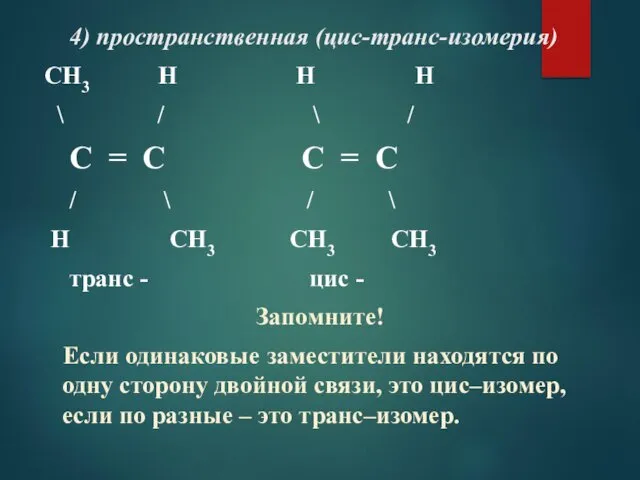
- 7. 4) пространственная (цис-транс-изомерия) CH3 H H H \ / \ / C = C C =
- 8. Номенклатура алкенов Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с
- 9. Получение алкенов 1) Дегидрирование (отщепление водорода) алканов при повышенной температуре с катализатором. t, kat СН3 –
- 10. Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 –
- 11. Химические свойства алкенов 1) Горение (полное окисление) При сжигании на воздухе алкены образуют углекислый газ и
- 12. В результате реакции наблюдается обесцвечивание раствора перманганата калия. H2C=CH2 + [О] + НОН → CH2−CH2 этилен-
- 13. 3) Реакции присоединения. а) Присоединение галогенов - Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к
- 14. б) Гидрирование – присоединение водорода. Алкены легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni) образуя
- 15. Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется
- 16. г) Гидратация – присоединение воды В присутствии минеральных кислот алкены присоединяют воду, образуя спирты. С2Н4 +
- 17. 4. Полимеризация - это процесс соединения многих маленьких одинаковых молекул в одну большую молекулу. При полимеризации
- 18. Применение алкенов Алкены широко используются в промышленности в качестве исходных веществ для получения многих важнейших продуктов.
- 19. Этилен ускоряет созревание плодов В качестве топлива Применение этилена и его производных:
- 20. Для получения алканов Этиленгликоль – для получения антифризов, тормозных жидкостей
- 21. Дихлорэтан – растворитель Дихлорэтан – для борьбы с вредителями (окуривание зернохранилищ) Дибромэтан – антидетонационная добавка в
- 22. Применение полиэтилена: А) Пленка Б) Тара В) Трубы Г) Сантехника Д) Изоляция проводов и кабелей
- 23. Е) Бронепанели в бронежилетах Ж) Предметы быта Применение этилена и его производных:
- 25. Скачать презентацию


















 Котельные установки и парогенераторы. Часть 2. Лекции 7 - 8
Котельные установки и парогенераторы. Часть 2. Лекции 7 - 8 Антарктида и ее обитатели
Антарктида и ее обитатели Основи мікро- і наноелектроніки. МДН транзистори. (Лекція 9)
Основи мікро- і наноелектроніки. МДН транзистори. (Лекція 9) Припуски на обработку и допуски на исполнительные размеры заготовок деталей. (Лекция 10)
Припуски на обработку и допуски на исполнительные размеры заготовок деталей. (Лекция 10) Микроконтроллеры AVR семейства Mega. Таймеры
Микроконтроллеры AVR семейства Mega. Таймеры Родительское собрание Дополнительное образование: занятия в детских объединениях - кружках.
Родительское собрание Дополнительное образование: занятия в детских объединениях - кружках. Возникновение науки и основные стадии её исторической эволюции
Возникновение науки и основные стадии её исторической эволюции Мир будущих профессий
Мир будущих профессий ПрезентацияМемориал Героическим защитникам Ленинграда
ПрезентацияМемориал Героическим защитникам Ленинграда Программа Качество на Кубани.
Программа Качество на Кубани. Буквы разные писать: моделирование букв (конспект, презентация).
Буквы разные писать: моделирование букв (конспект, презентация). Паразитизм. Виды паразитизма. Паразитология
Паразитизм. Виды паразитизма. Паразитология Модернизация стенда вакуумного охлаждения и замораживания
Модернизация стенда вакуумного охлаждения и замораживания Моделирование химико-технологических процессов
Моделирование химико-технологических процессов Методы исследования механической активности сердца
Методы исследования механической активности сердца Умный дом
Умный дом Общие сведения о каналах утечки информации, обрабатываемой ТСПИ, через ПЭМИН
Общие сведения о каналах утечки информации, обрабатываемой ТСПИ, через ПЭМИН Нравственные ценности как регулятор профессионального поведения журналиста
Нравственные ценности как регулятор профессионального поведения журналиста Что такое макроэкономика по-австрийски?
Что такое макроэкономика по-австрийски? Информатизация образовательного процесса – условие формирования информационной компетентности учащихся и педагогов
Информатизация образовательного процесса – условие формирования информационной компетентности учащихся и педагогов мини - музей Хлеб всему голова
мини - музей Хлеб всему голова 20231110_road_safety_dos_and_donts_6_klass
20231110_road_safety_dos_and_donts_6_klass Первые христиане и их учение
Первые христиане и их учение викторина 1
викторина 1 Классификация схем трещин каменного здания
Классификация схем трещин каменного здания Дидактическая игра
Дидактическая игра Пространственный анализ данных в ГИС. Лекция 15
Пространственный анализ данных в ГИС. Лекция 15 Платье на счастье
Платье на счастье