Содержание
- 2. plan Natura chimica a enzimelor Centrul activ şi alosteric Activatorii şi inhibitorii Mecanismul acţiunii enzimelor
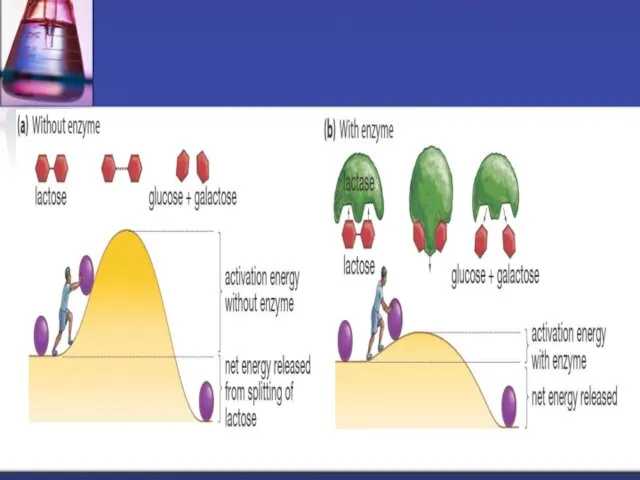
- 3. enzime - sunt catalizatori biochimici , care măresc viteza reacţiilor chimice ce se desfăşoră în sistemele
- 4. Enzime enzime endogene - enzimele digestive (ajută la scindarea moleculelor mari provenite din hrană, în structuri
- 5. denumirea substrat + аzа = denumirea lipidele + аzа = lipaza proteine + аzа = proteaza
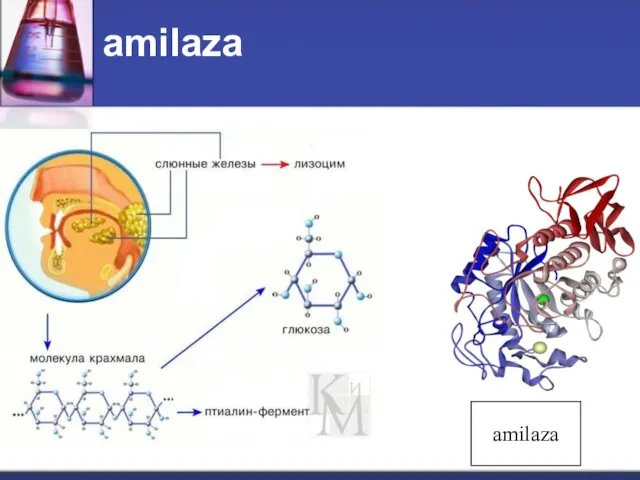
- 6. amilaza amilaza
- 7. Rolul enzimelor: E sunt implicate în majoritatea proceselor care au loc in organism procesele de digestie
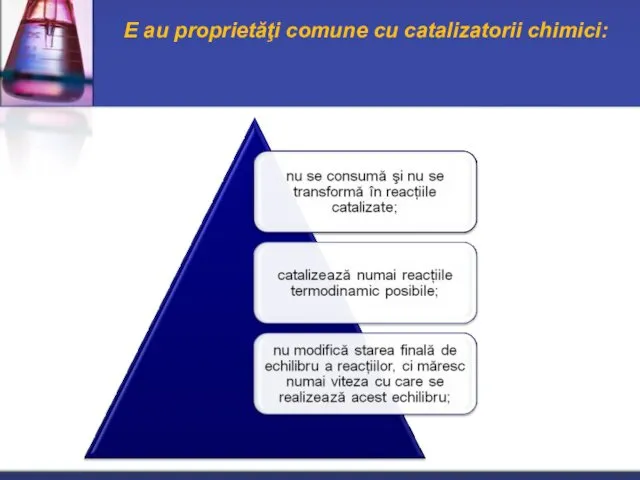
- 8. E au proprietăţi comune cu catalizatorii chimici:
- 9. Proprietăţi specifice numai E:
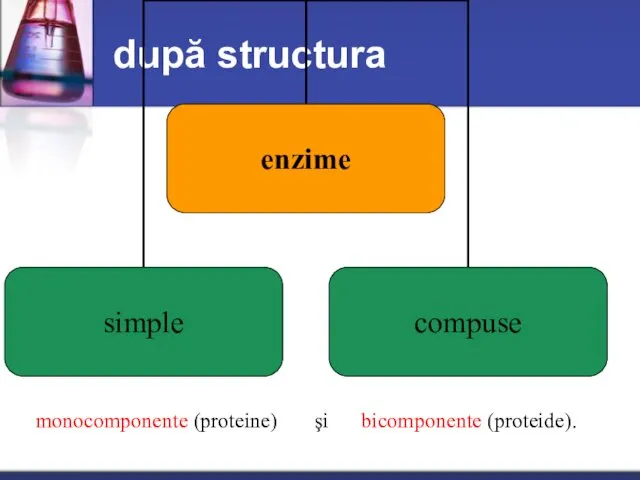
- 10. după structura monocomponente (proteine) şi bicomponente (proteide).
- 11. Enzime compuse - holoenzime holoenzima = apoenzima + cofactor Partea proteică termolabilă Partea neproteică termostabilă Apoenzima
- 12. După modul de legare la apoenzimă cofactorii se clasifică în coenzime (uşor disociabile) grupări prostetice (nedisociabile).
- 13. După structura chimică cofactorii se divizează
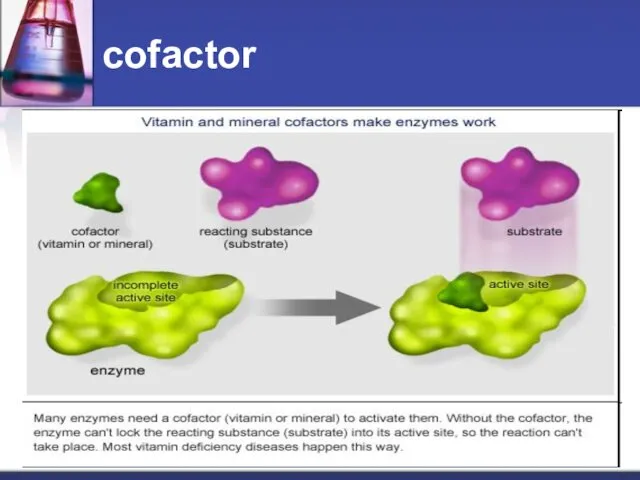
- 14. cofactor
- 15. Proprietăţile cofactorilor:
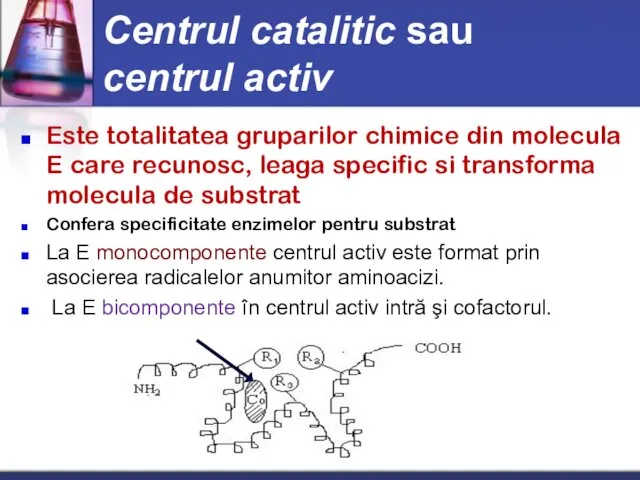
- 16. Centrul catalitic sau centrul activ Este totalitatea gruparilor chimice din molecula E care recunosc, leaga specific
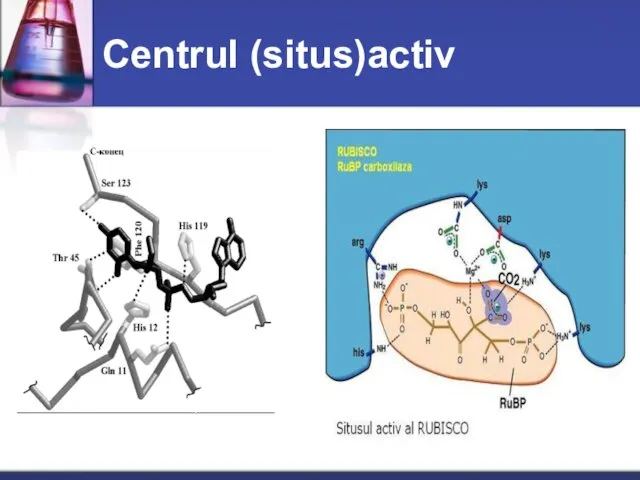
- 17. Centrul (situs)activ
- 18. "cheie - lacăt" Centrul activ se află în partea internă hidrofobă a moleculei proteice. Organizarea lui
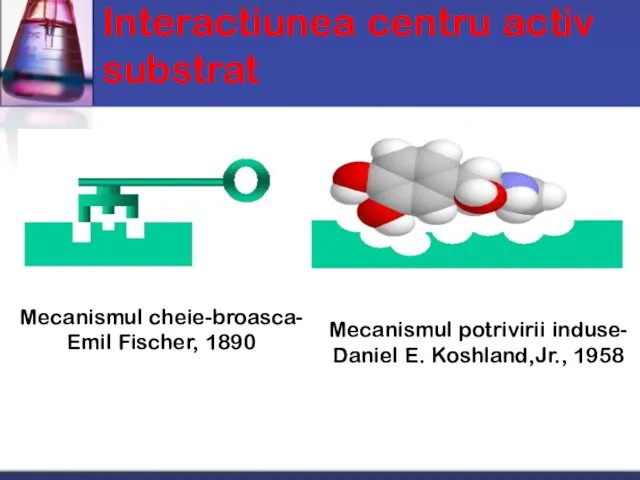
- 19. Interactiunea centru activ substrat Mecanismul cheie-broasca- Emil Fischer, 1890 Mecanismul potrivirii induse- Daniel E. Koshland,Jr., 1958
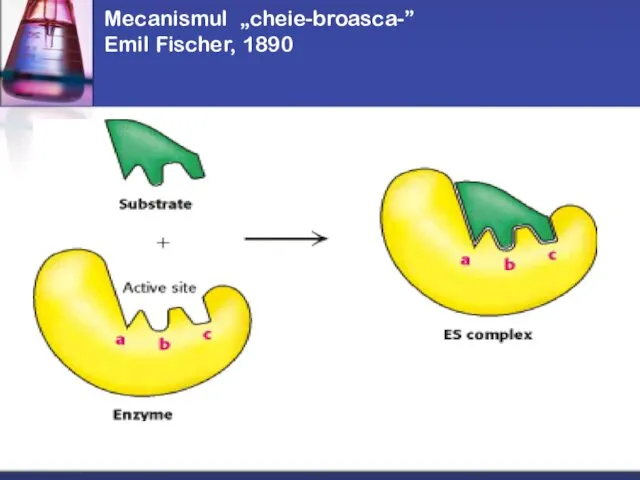
- 20. Mecanismul „cheie-broasca-” Emil Fischer, 1890
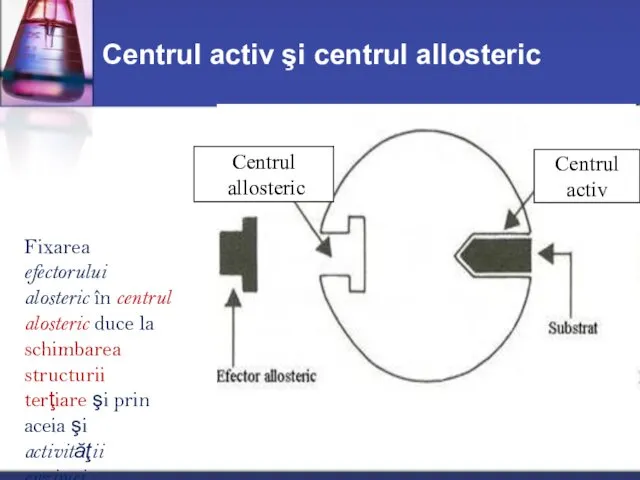
- 21. Centrul activ şi centrul allosteric Centrul allosteric Centrul activ Fixarea efectorului alosteric în centrul alosteric duce
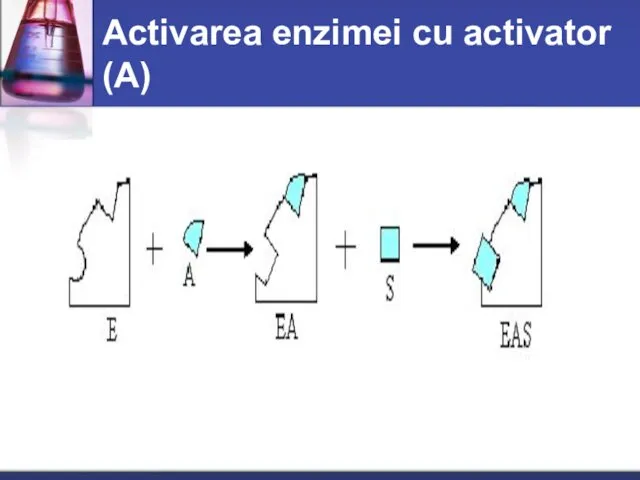
- 22. Activarea enzimei cu activator (А)
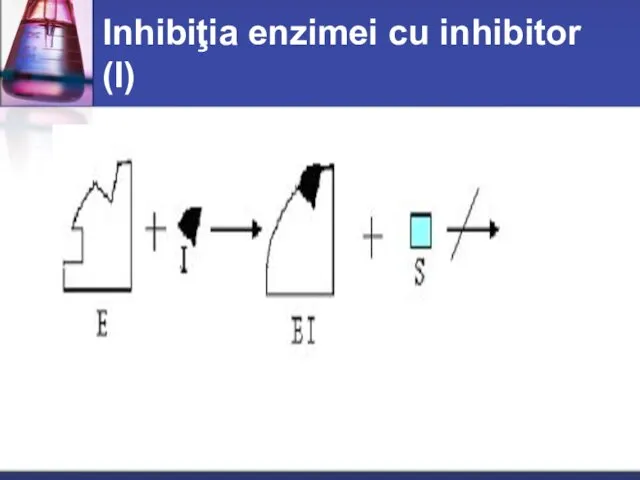
- 23. Inhibiţia enzimei cu inhibitor (I)
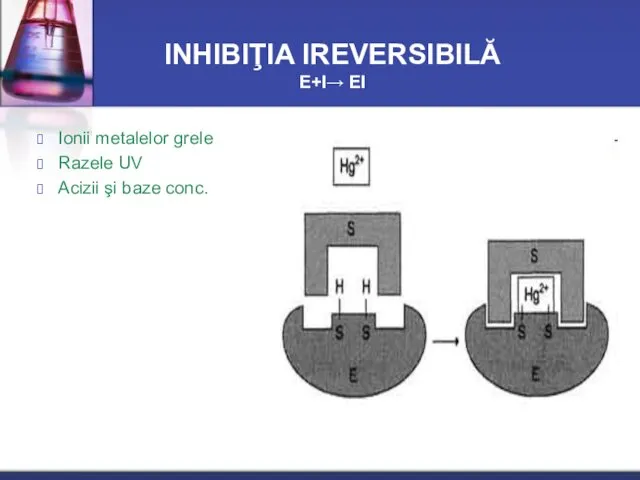
- 24. INHIBIŢIA IREVERSIBILĂ Е+I→ ЕI Ionii metalelor grele Razele UV Acizii şi baze conc.
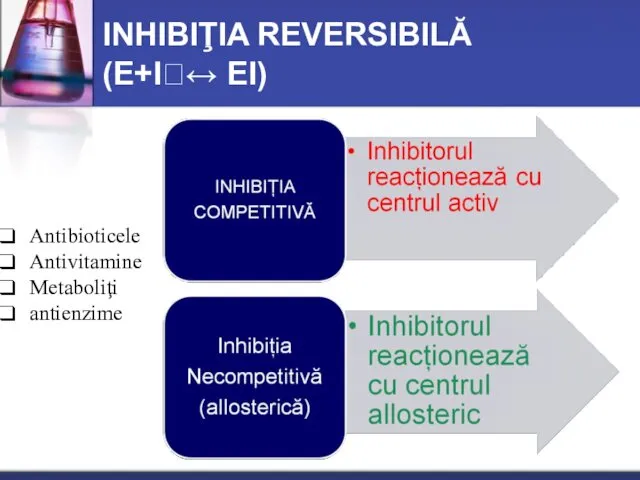
- 25. INHIBIŢIA REVERSIBILĂ (Е+I↔ ЕI) Antibioticele Antivitamine Metaboliţi antienzime
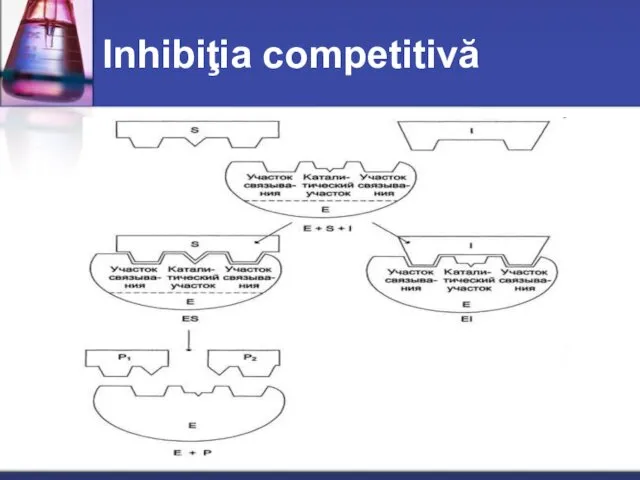
- 26. Inhibiţia competitivă
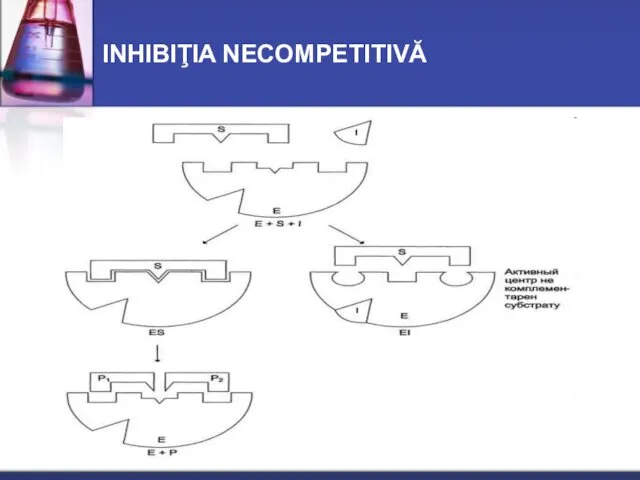
- 27. INHIBIŢIA NECOMPETITIVĂ
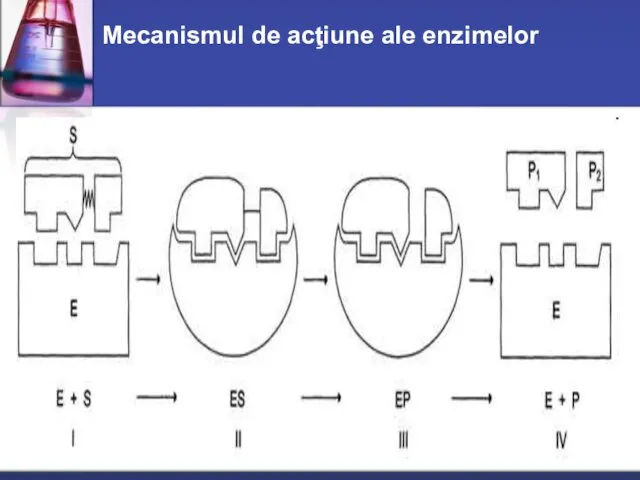
- 29. Procesul catalizei enzimatice poate fi divizat convenţional în 3 stadii:
- 30. Mecanismul de acţiune ale enzimelor
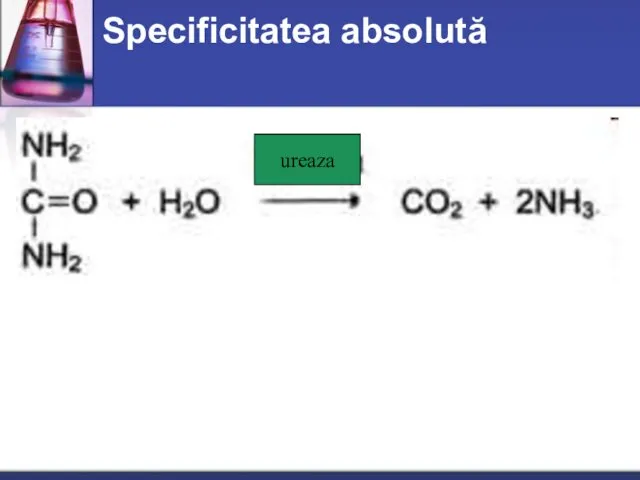
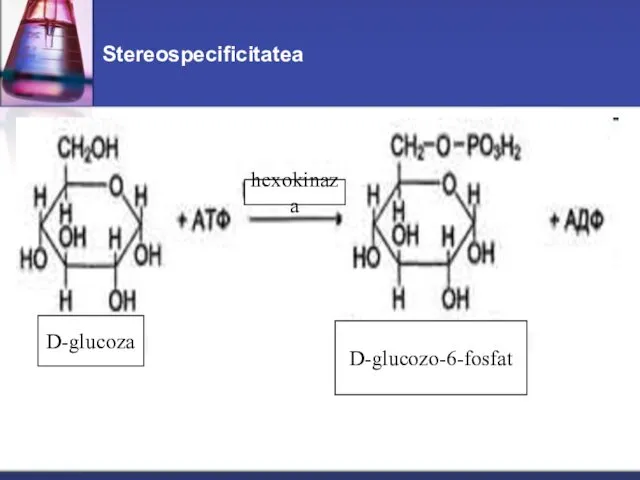
- 31. specificitatea De grup absolută stereospecificitatea
- 32. Specificitatea absolută ureaza
- 33. Stereospecificitatea D-glucoza D-glucozo-6-fosfat hexokinaza
- 34. Cinetica reacţiilor enzimatice Studiază funcţia reacţiei enzimatice în dependenţa de natura chimică a substanţelor reagente, concentraţia
- 35. Viteza reacţiilor enzimatice depinde de: Concentraţia substratului concentraţia enzimelor; temperatura; рН ; activatori; inhibitori;
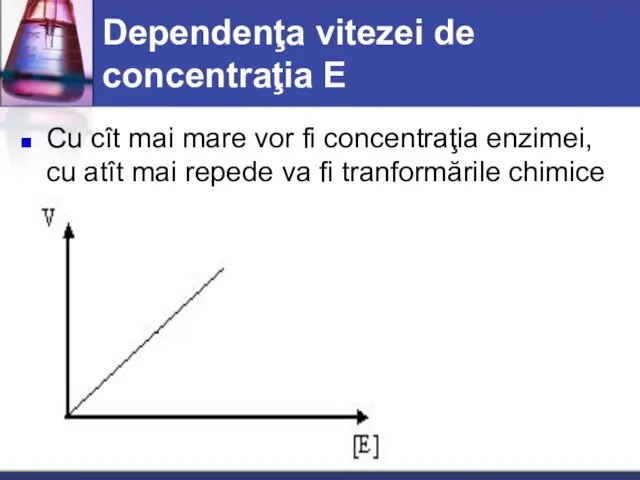
- 36. Dependenţa vitezei de concentraţia E Cu cît mai mare vor fi concentraţia enzimei, cu atît mai
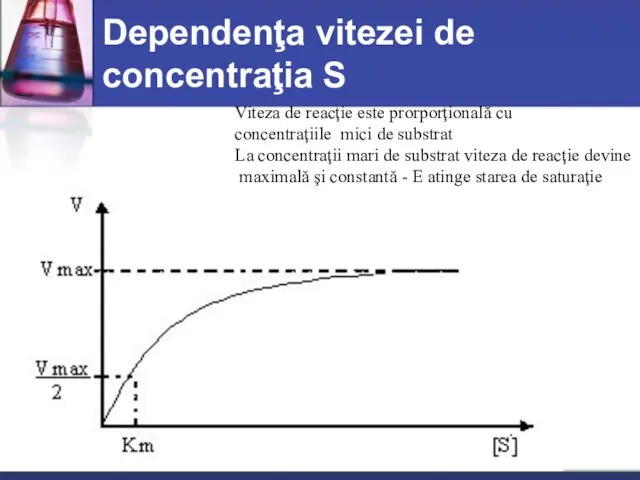
- 37. Dependenţa vitezei de concentraţia S Viteza de reacţie este prorporţională cu concentraţiile mici de substrat La
- 38. ecuaţia Michaelis-Menten în care: V- este viteza de reacţie la un moment dat; Vmax — viteza
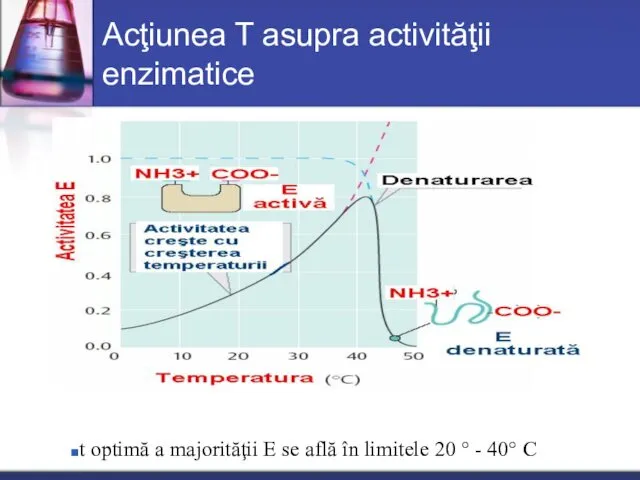
- 39. Acţiunea T asupra activităţii enzimatice t optimă a majorităţii E se află în limitele 20 °
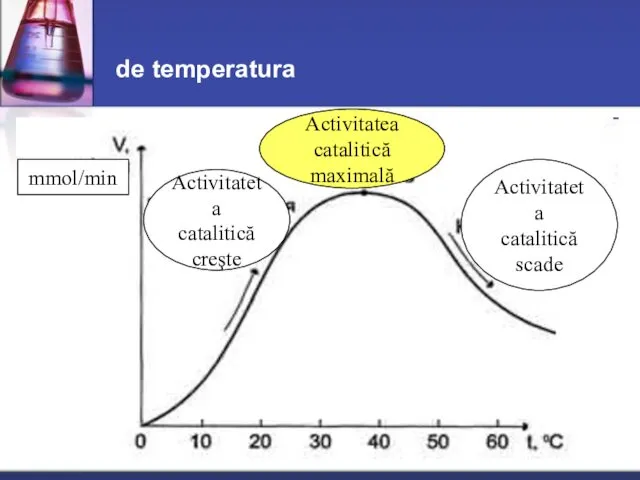
- 40. de temperatura Activitatea catalitică maximală Activitateta catalitică creşte Activitateta catalitică scade mmol/min
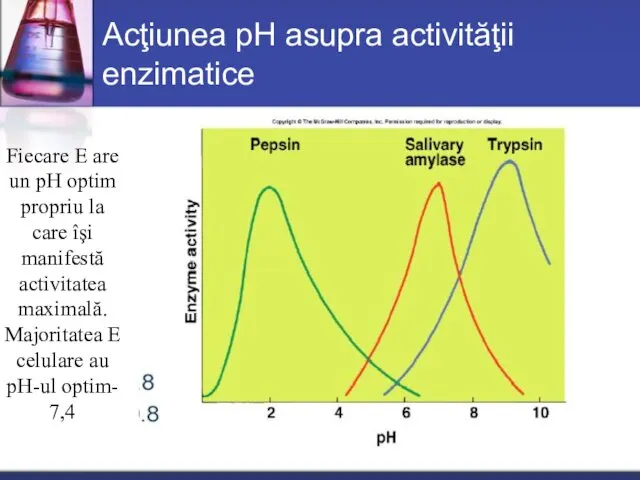
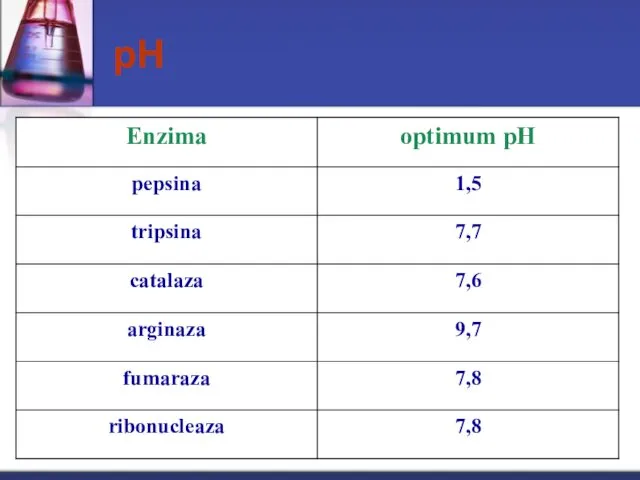
- 41. Acţiunea pH asupra activităţii enzimatice Fiecare E are un pH optim propriu la care îşi manifestă
- 42. рН
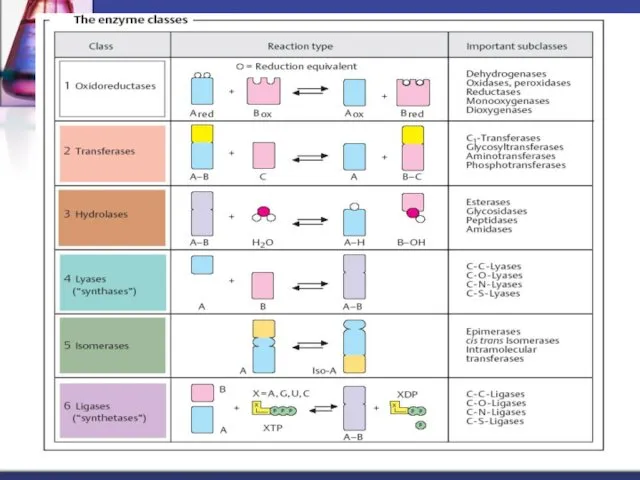
- 43. Clasificarea şi nomenclatura 1 clasa. Oxidoreductaze 2 clasa. Transferaze 3 clasa. Hidrolaze 4 clasa. Liaze 5
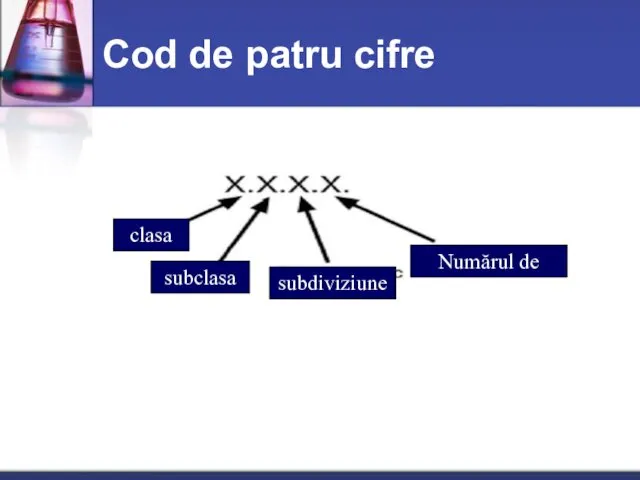
- 44. Cod de patru cifre clasa subclasa subdiviziune Numărul de ordine
- 45. 1 Clasa Oxidoreductazelor # dehidrodenaze, oxidaze dehidrogenazele care catalizează reacţiile dehidrogenării după următoarea schemă: acceptor ↓
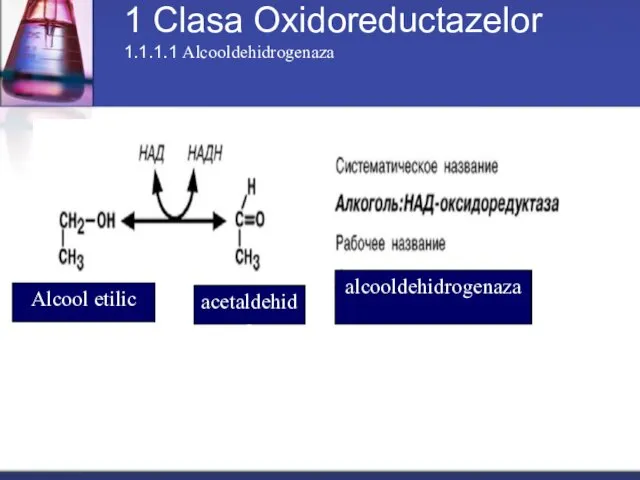
- 46. 1 Clasa Oxidoreductazelor 1.1.1.1 Alcooldehidrogenaza alcooldehidrogenaza Alcool etilic acetaldehida
- 47. 2 Clasa Transferazelor # transaminaze, kinaze, metiltransferaze catalizează reacţiile de transfer a diferitor grupe şi radicali
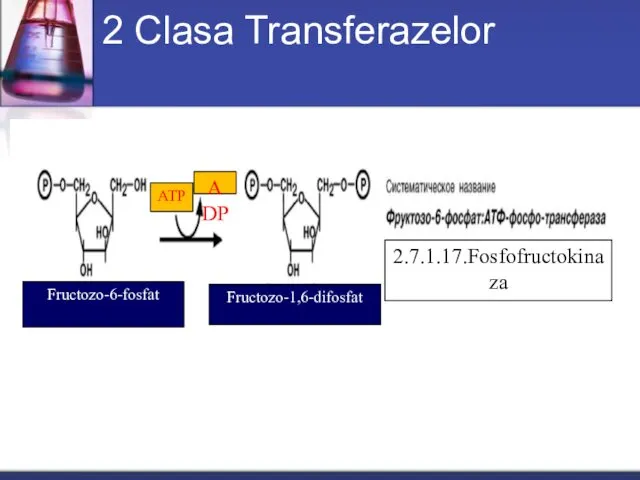
- 48. 2 Clasa Transferazelor Fructozo-6-fosfat Fructozo-1,6-difosfat 2.7.1.17.Fosfofructokinaza ADP ATP
- 49. 3 Clasa Hidrolazelor # peptidaze, glicozidaze, esteraze catalizează scindarea legăturilor chimice cu participarea moleculelor de apă
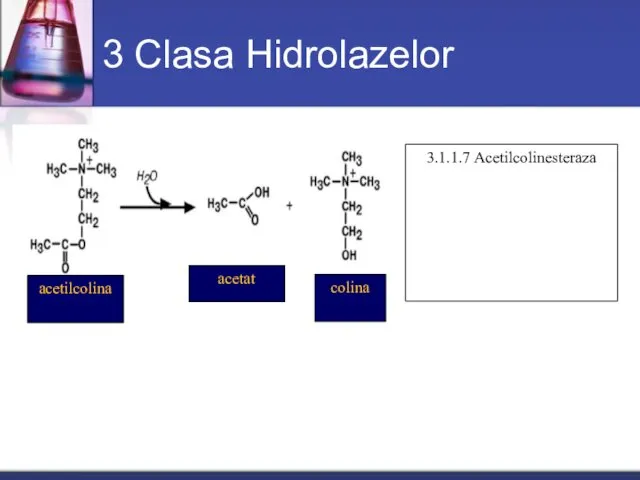
- 50. 3 Clasa Hidrolazelor acetilcolina acetat colina 3.1.1.7 Acetilcolinesteraza
- 51. 4 Clasa Liazelor # decarboxilaze, mutaze catalizează reacţiile de scindarea nehidrolitică a legăturilor chimice. Se elimină
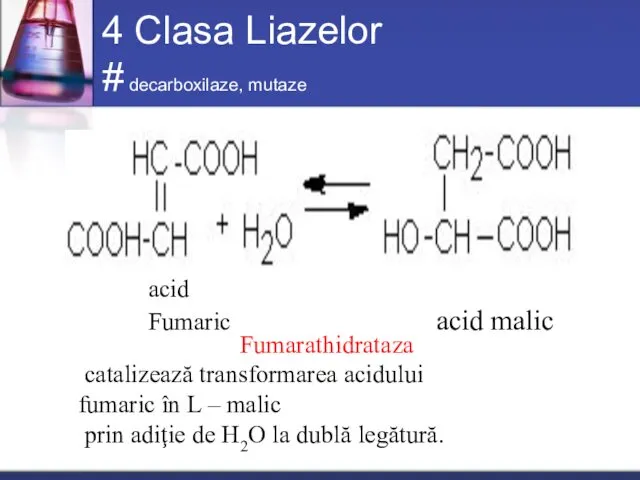
- 52. 4 Clasa Liazelor # decarboxilaze, mutaze Fumarathidrataza catalizează transformarea acidului fumaric în L – malic prin
- 53. 5 Clasa Izomerazelor # mutaze, racemaze catalizează reacţiile de izomerizare. 3- fosfoglicerat 2- fosfoglicerat 5.4.2.1. Fosfogliceromutaza
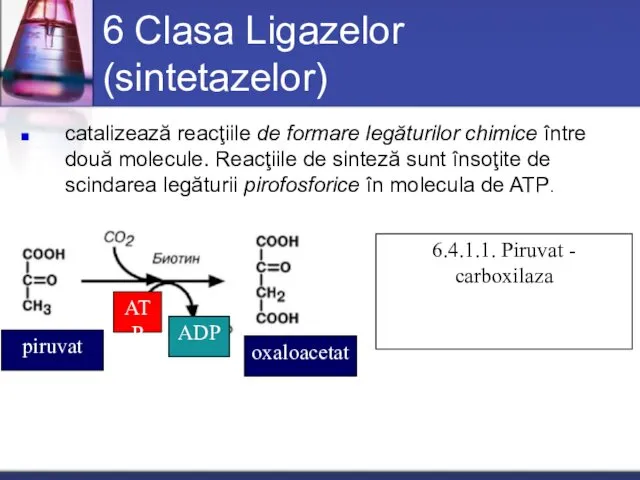
- 54. 6 Clasa Ligazelor (sintetazelor) catalizează reacţiile de formare legăturilor chimice între două molecule. Reacţiile de sinteză
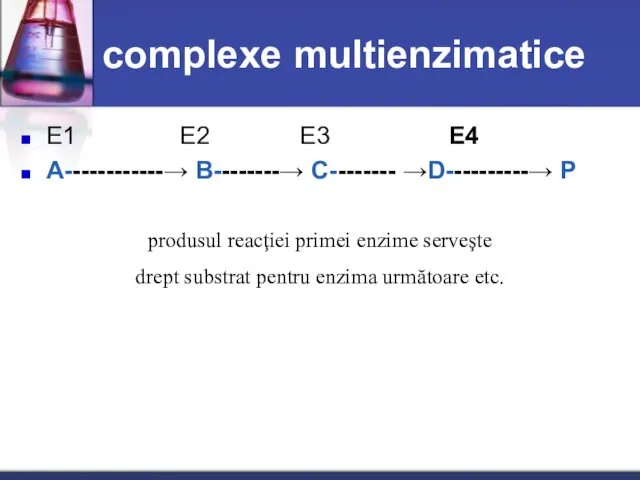
- 56. complexe multienzimatice E1 E2 E3 E4 A------------→ B--------→ C-------- →D----------→ P produsul reacţiei primei enzime serveşte
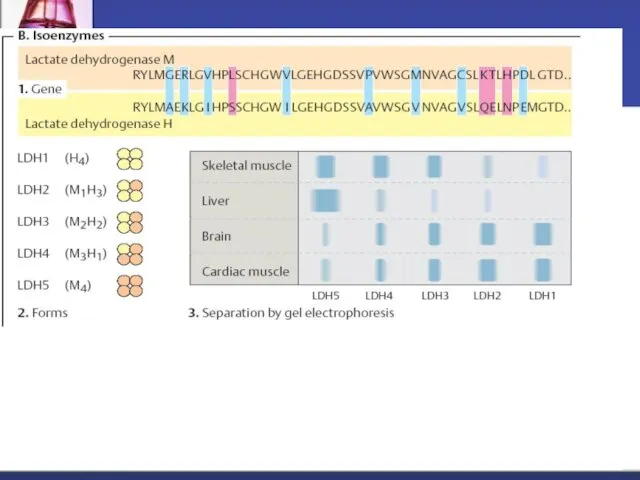
- 57. Sunt enzime localizate în aceeaşi celulă sau în celule diferite, îndeplinesc funcţii catalitice identice: Au acelaşi
- 59. Proenzimele nu îndeplinesc rolul de biocatalizatori, decât dacă sunt activate de anumiţi factori sau de către
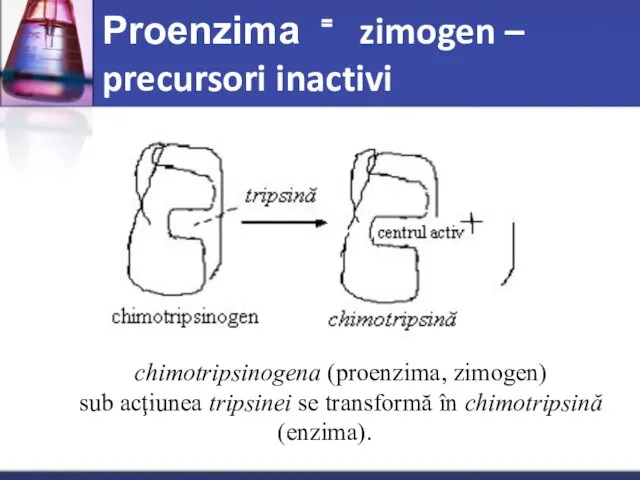
- 60. Proenzima ⁼ zimogen – precursori inactivi chimotripsinogena (proenzima, zimogen) sub acţiunea tripsinei se transformă în chimotripsină
- 61. Direcţiile enzimologiei
- 62. Importanţa E digestive Suplimentele enzimatice compensează o sinteză insuficientă a acestor elemente în corp în cazul
- 63. Enzimoterapia Terapia moderna cu enzime dateaza de la inceputul secolului XX. In 1906 dr. John Beard,
- 64. E metabolice regleaza procesele metabolice interne CATALAZA -efect antioxidant prin descompunerea peroxidului de hidrogen în apă
- 65. Enzimodiagnostica (E-markeri) Alanin-aminotransferaza ( ALT) - are o localizare în interiorul celulelor rinichilor şi ficatului. Nivelul
- 66. Enzimopatologia HEMOFILIA А – constă într-o predispoziţie spre HEMORAGIE, cauzată de deficitul factorului VIII coagulării şi
- 68. Скачать презентацию






























 Процедура визита и навыки планирования работы торгового представителя
Процедура визита и навыки планирования работы торгового представителя Экологический мини проект в старшей группе О чем молчат деревья
Экологический мини проект в старшей группе О чем молчат деревья Викторина Материки и океаны
Викторина Материки и океаны Презентация История мультипликации
Презентация История мультипликации Презентация к классному часу Долг в жизни людей разных профессий.
Презентация к классному часу Долг в жизни людей разных профессий. Презентаци к открытому уроку Углеводы
Презентаци к открытому уроку Углеводы Диагностика пневмококковой инфекции
Диагностика пневмококковой инфекции Унифицированный язык моделирования UML
Унифицированный язык моделирования UML Лекция 3. Эволюция теории менеджмента
Лекция 3. Эволюция теории менеджмента Презентация. Не спешите срывать первоцветы. В рамках проекта Оставьте цветы весне
Презентация. Не спешите срывать первоцветы. В рамках проекта Оставьте цветы весне Международные и национальные природные ресурсы
Международные и национальные природные ресурсы Директора заводов
Директора заводов Первая медицинская помощь при черепно-мозговой травме и повреждении позвоночника
Первая медицинская помощь при черепно-мозговой травме и повреждении позвоночника Семья Ростовых и семья Болконских
Семья Ростовых и семья Болконских Интернет-ресурсы
Интернет-ресурсы Учнівське портфоліо Гончарової Олени Сергіївни
Учнівське портфоліо Гончарової Олени Сергіївни Магистрально-модульный принцип построения компьютера
Магистрально-модульный принцип построения компьютера Презентация Образ матери в произведениях искусства
Презентация Образ матери в произведениях искусства Материаловедение
Материаловедение Удобрення закритого грунту при вирощуванні декоративних культур
Удобрення закритого грунту при вирощуванні декоративних культур Проект Русский фольклор как важный элемент развития и воспитания детей младшего возраста
Проект Русский фольклор как важный элемент развития и воспитания детей младшего возраста Презентация Всё о яблоках
Презентация Всё о яблоках Скоро в школу
Скоро в школу Презентация Святки
Презентация Святки Защита человека и среды обитания от вредных и опасных факторов антропогенного, техногенного и природного происхождения
Защита человека и среды обитания от вредных и опасных факторов антропогенного, техногенного и природного происхождения Инфразвук. Влияние инфразвука на организм человека. Защита от инфразвука
Инфразвук. Влияние инфразвука на организм человека. Защита от инфразвука Собираем урожай
Собираем урожай Классный час Мы - за здоровый образ жизни!
Классный час Мы - за здоровый образ жизни!