Содержание
- 2. Нуклеотиды и их производные используются в организме в качестве: • субстратов синтеза ДНК, РНК (нуклеозидтрифосфаты) и
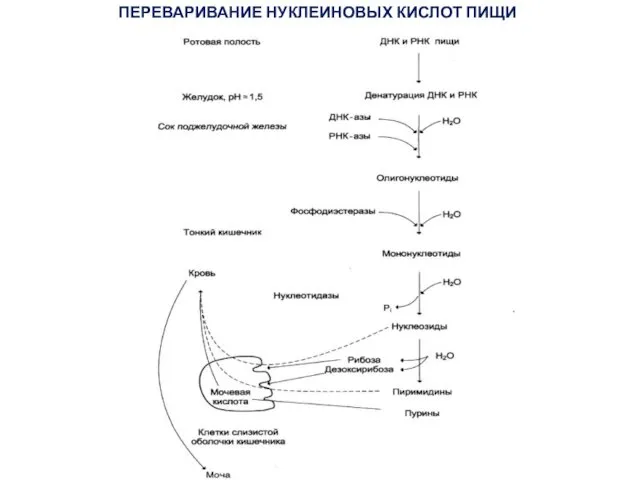
- 3. ПЕРЕВАРИВАНИЕ НУКЛЕИНОВЫХ КИСЛОТ ПИЩИ
- 4. Распад нуклеиновых кислот происходит в тонкой кишке в основном гидролитическим путем под действием ДНК- и РНКазы
- 5. СИНТЕЗ ПУРИНОВЫХ НУКЛЕОТИДОВ
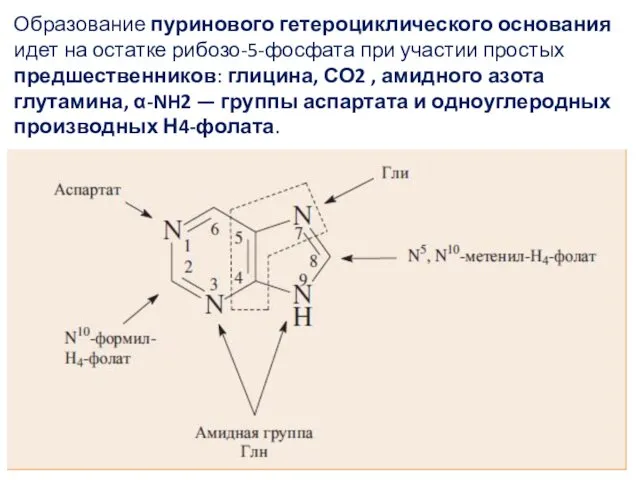
- 6. Образование пуринового гетероциклического основания идет на остатке рибозо-5-фосфата при участии простых предшественников: глицина, СО2 , амидного
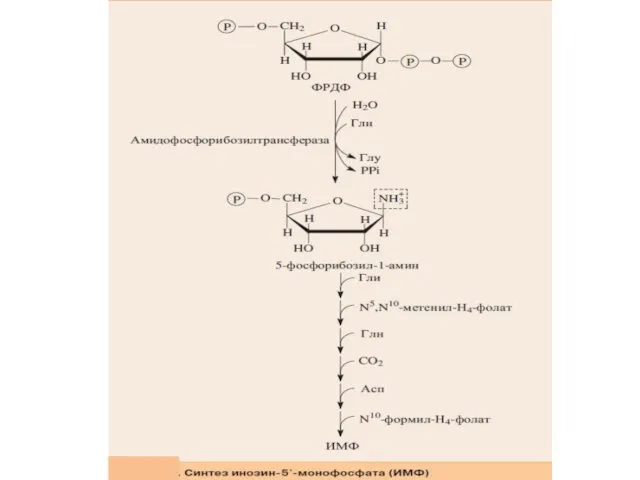
- 7. Сначала формируется 5-членное кольцо, а затем 6-членное с образованием первого пуринового нуклеотида — инозинмонофосфата или ИМФ.
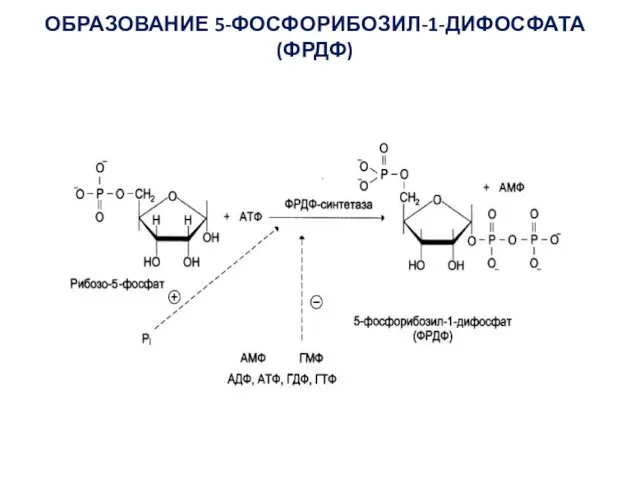
- 8. ОБРАЗОВАНИЕ 5-ФОСФОРИБОЗИЛ-1-ДИФОСФАТА (ФРДФ)
- 9. В организме почти все клетки способны к синтезу нуклеотидов. Центральное место в синтезе пуриновых и пиримидиновых
- 11. Скорость-лимитирующей и регуляторной стадией процесса является образование 5-фосфорибозил-1-амина, которую катализирует амидофосфорибозилтрансфераза. В ходе этой реакции амидная
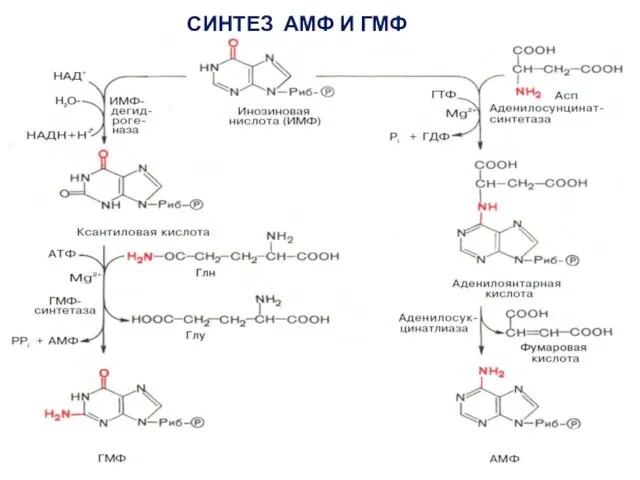
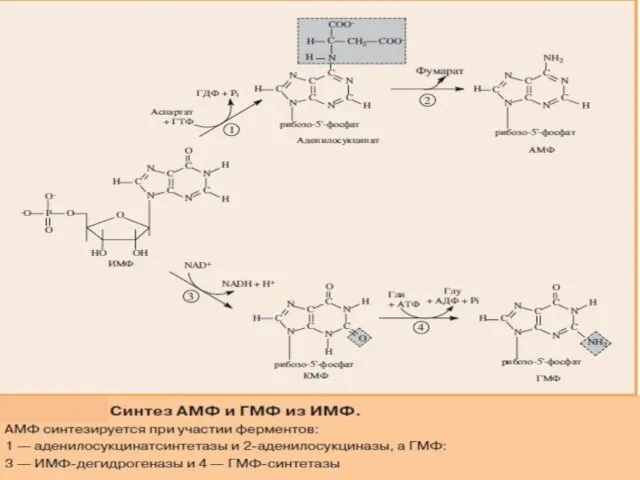
- 12. СИНТЕЗ АМФ И ГМФ
- 14. В ферментативном синтезе АМФ из ИМФ специфическое участие принимает аспарагиновая кислота, являющаяся донором NH2-группы, и ГТФ
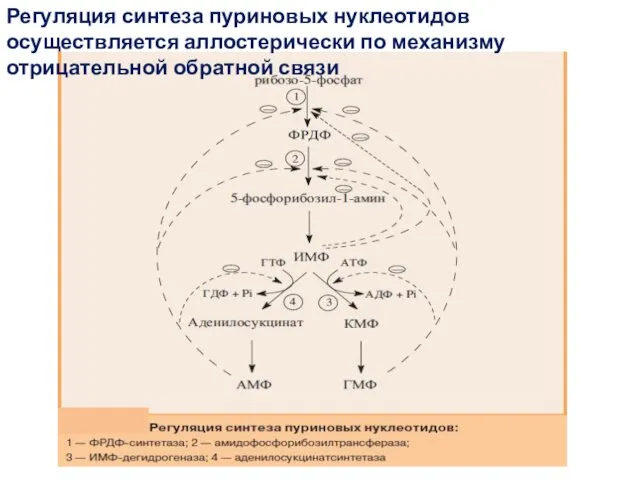
- 15. Регуляция синтеза пуриновых нуклеотидов осуществляется аллостерически по механизму отрицательной обратной связи
- 16. АМФ, ГМФ и ИМФ ингибируют ключевые реакции своего синтеза. Два фермента: ФРДФ-синтетаза и амидофосфорибозилтрансфераза ингибируются лишь
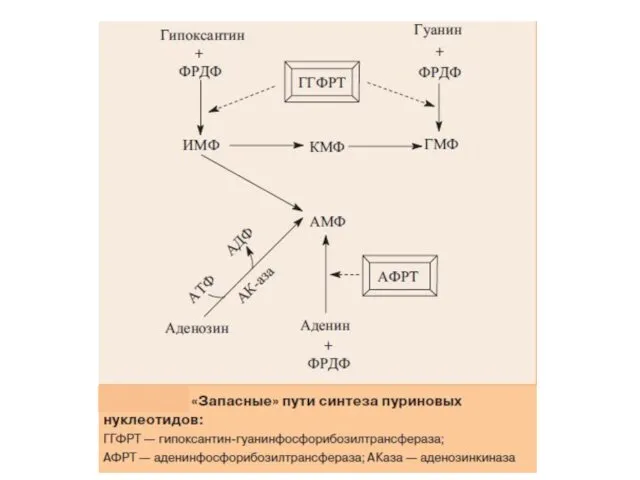
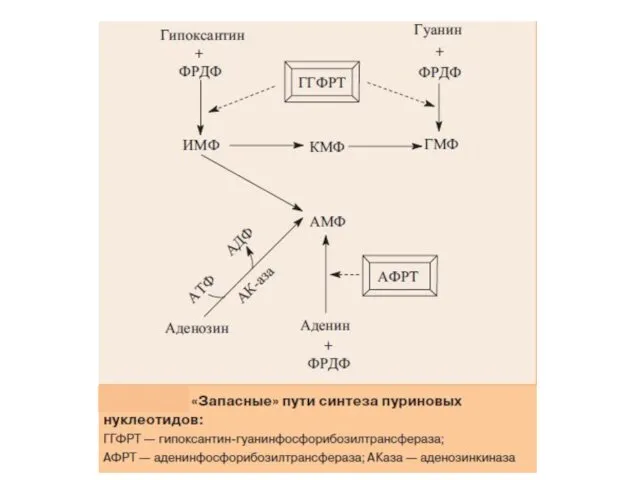
- 17. «Запасные» пути синтеза пуриновых нуклеотидов
- 18. «Запасные» пути синтеза пуриновых нуклеотидов играют заметную роль в периоды активного роста тканей, когда основной путь
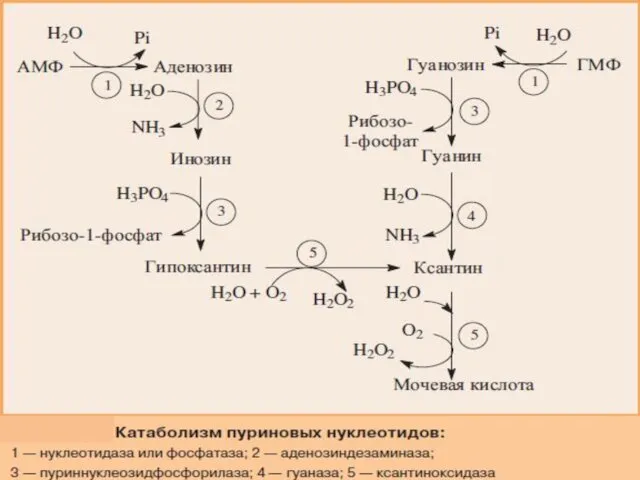
- 20. Катаболизм пуриновых нуклеотидов
- 22. У человека катаболизм пуриновых нуклеотидов заканчивается образованием мочевой кислоты. Первоначально нуклеотиды гидролитически теряют фосфатный остаток в
- 23. Мочевая кислота удаляется из организма человека главным образом с мочой и немного с фекалиями. Она является
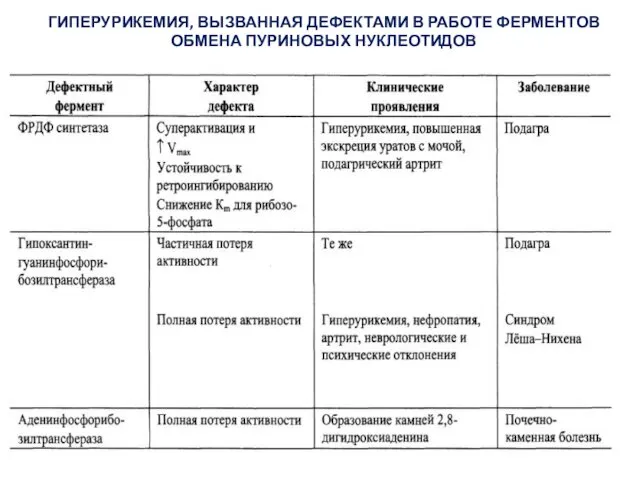
- 24. Гиперурикемия и подагра
- 25. Частым нарушением катаболизма пуринов является гиперурикемия, которая возникает, когда в плазме крови концентрация мочевой кислоты превышает
- 26. При полной потере активности гипоксантингуанинфосфорибозил-трансферазы развивается тяжелая форма гиперурикемии — синдром Леша–Найхана, при котором наблюдаются неврологические
- 27. ГИПЕРУРИКЕМИЯ, ВЫЗВАННАЯ ДЕФЕКТАМИ В РАБОТЕ ФЕРМЕНТОВ ОБМЕНА ПУРИНОВЫХ НУКЛЕОТИДОВ
- 29. Биосинтез и катаболизм пиримидиновых нуклеотидов
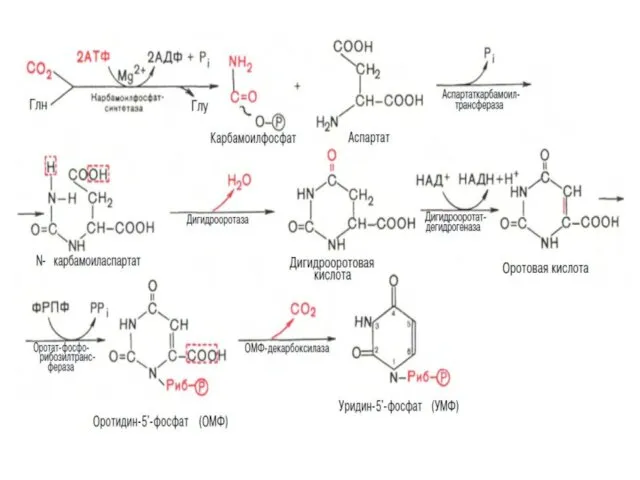
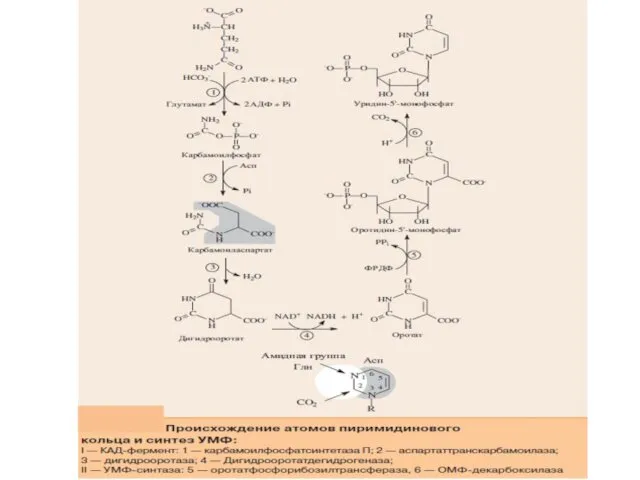
- 30. В отличие от синтеза пуриновых нуклеотидов, при котором азотистое основание формируется на остатке рибозо-5-фосфата, пиримидиновое кольцо
- 33. I стадия синтеза УМФ включает катализируемое цитолазматической карбамоилфосфатсинтетазой образование карбамоилфосфата из глутамина. На II стадии карбамоилфосфат
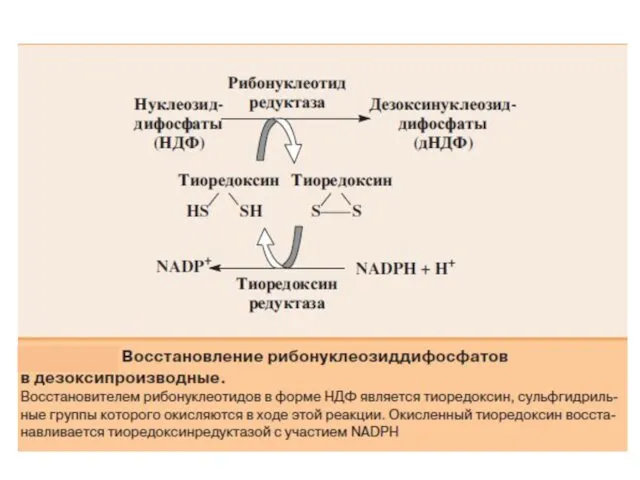
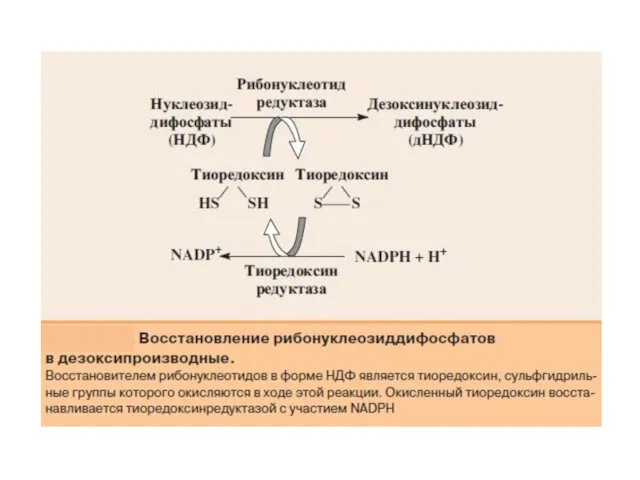
- 34. Превращение УМФ в УДФ и УТФ осуществляется, как и пуриновых нуклеотидов, путем фосфотрансферазных реакций: УМФ +
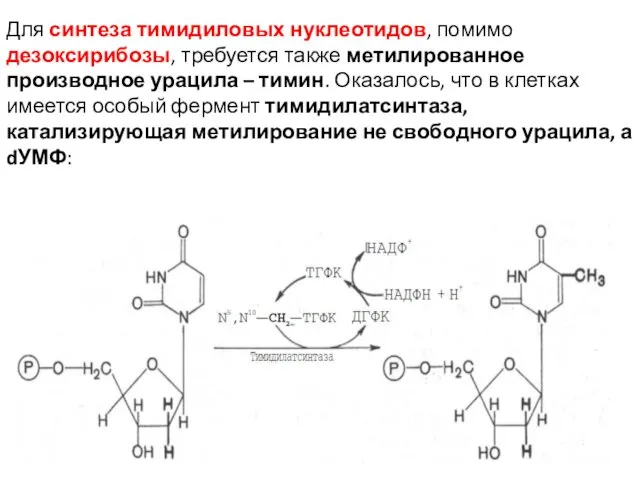
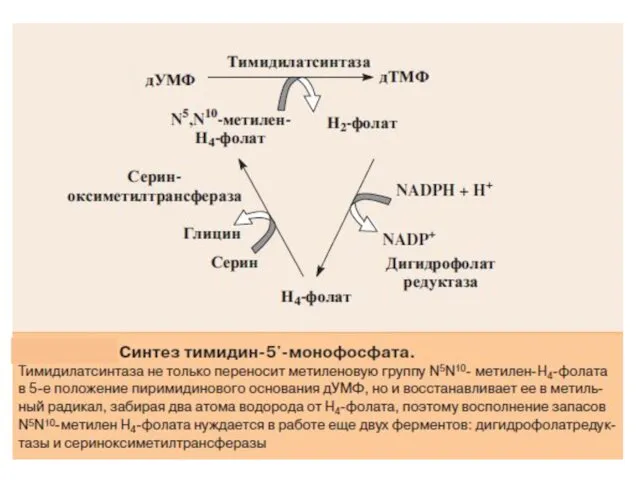
- 36. Для синтеза тимидиловых нуклеотидов, помимо дезоксирибозы, требуется также метилированное производное урацила – тимин. Оказалось, что в
- 38. Донором метильной группы в тимидилатсинтазной реакции является N5,N10-метилен-ТГФК, которая одновременно отдает и водородный протон, поэтому одним
- 40. Регуляция синтеза пиримидиновых нуклеотидов осуществляется аллостерически по механизму отрицательной обратной связи: – УТФ ингибирует активность карбамоилфосфатсинте-тазы;
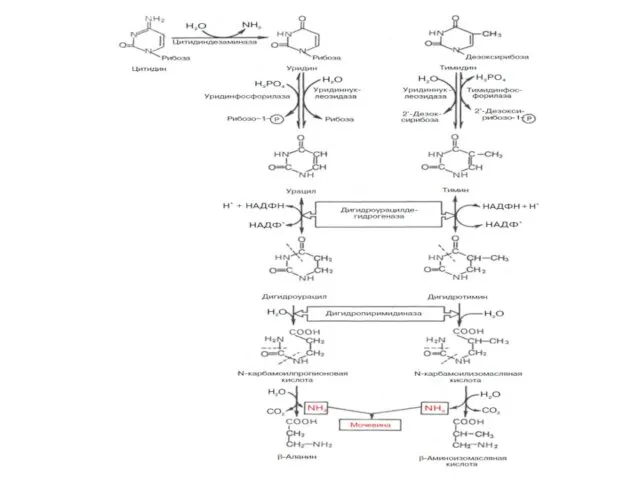
- 41. Распад пиримидиновых нуклеозидов
- 43. Начальные этапы реакции распада пиримидиновых нуклеотидов катализируются специфическими ферментами. Конечными продуктами реакции являются СО2, NH3, мочевина,
- 45. Скачать презентацию
























 Игрушки к Новому Году для детей и родителей
Игрушки к Новому Году для детей и родителей Шаблон Фракталы-23
Шаблон Фракталы-23 Основание греческих колоний
Основание греческих колоний РЕБУС DМ. Розгадай шифр — дізнайся нові правила Winston
РЕБУС DМ. Розгадай шифр — дізнайся нові правила Winston Химическая связь
Химическая связь Атенюатори і вимірювання послаблень. Прилади для вимірювання послаблень. (Тема 16.1)
Атенюатори і вимірювання послаблень. Прилади для вимірювання послаблень. (Тема 16.1) Уровни структуры методологического знания. Примеры научного знания каждого уровня
Уровни структуры методологического знания. Примеры научного знания каждого уровня Живопись XVIII века
Живопись XVIII века Для Вас, выпускники: весна 2 класс
Для Вас, выпускники: весна 2 класс Мифическое время правремя, начальное, раннее, первое, предшествующее эмпирическому (профанному) времени
Мифическое время правремя, начальное, раннее, первое, предшествующее эмпирическому (профанному) времени Туристские формальности стран Скандинавии
Туристские формальности стран Скандинавии Классификация и определения механизмов. (Лекция 1)
Классификация и определения механизмов. (Лекция 1) Своя игра на тему Здоровый образ жизни
Своя игра на тему Здоровый образ жизни Дизайн. Тренды в графическом дизайне 2017
Дизайн. Тренды в графическом дизайне 2017 Новогодняя открытка 2019
Новогодняя открытка 2019 Сретение Господне
Сретение Господне Презентация Домашние птицы.
Презентация Домашние птицы. Конструктивные решения по усилению строительных конструкций
Конструктивные решения по усилению строительных конструкций ВозможностиЕ-КМ школы
ВозможностиЕ-КМ школы Методика сортоизучения древесных растений
Методика сортоизучения древесных растений Зонная теория твердого тела
Зонная теория твердого тела Время реакции человека
Время реакции человека Программа коррекционно-развивающей работы с детьми с задержкой психического развития
Программа коррекционно-развивающей работы с детьми с задержкой психического развития Психологические особенности периода взрослости
Психологические особенности периода взрослости Театрализованная игра как средство развития интонационной выразительности речи детей старшего дошкольного возраста
Театрализованная игра как средство развития интонационной выразительности речи детей старшего дошкольного возраста Физико-химические свойства пластовых флюидов. Условия притока жидкостей и газов. (Лекция 2)
Физико-химические свойства пластовых флюидов. Условия притока жидкостей и газов. (Лекция 2) Русская архитектура первой половины 19 века
Русская архитектура первой половины 19 века Оборудование кондитерского цеха
Оборудование кондитерского цеха