Содержание
- 2. Классификация реакций Протекающие без изменения степени окисления Ag +1Cl -1+Na +12S -2 Ag +12S -2+Na +1Cl-1
- 3. Понятие окислительно-восстановительных реакций Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ,
- 4. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Атом превращается в положительно заряженный ион: Zn0
- 5. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Атом превращается в отрицательно заряженный ион S0
- 6. Восстановители - атомы, молекулы или ионы, отдающие электроны. Они в процессе ОВР окисляются Типичные восстановители: ●
- 7. Окислители - атомы, молекулы или ионы, присоединяющие электроны. Они в процессе ОВР восстанавливаются Типичные окислители: ●
- 8. Классификация окислительно-восстановительных реакций Реакции межмолекулярного окисления 2Al0 + 3Cl20 → 2Al+3 Cl3-1 Реакции внутримолекулярного окисления 2KCl+5O3-2
- 10. Составление формул по СО +1 -1 H Cl +1 -2 H2O +1 -3 H3N +4-1 C
- 11. Значение ОВР ОВР чрезвычайно распространены. С ними связаны процессы обмена веществ в живых организмах, дыхание, гниение,
- 12. Запиши знаки химических элементов, образующих соединение*, проставь с.о. атомов или заряды ионов +3 –2 СrO Сr2O3
- 13. Задание Определи степени окисления атомов элементов, входящих в состав веществ: а) AlCl3, H2Se, CaH2, SiF4, AlN,
- 15. Скачать презентацию












 Семейная реликвия
Семейная реликвия Проект:Сохрани свое здоровье сам
Проект:Сохрани свое здоровье сам Смешанное и искусственное вскармливание
Смешанное и искусственное вскармливание Джонатан Свифт Путешествия Гулливера
Джонатан Свифт Путешествия Гулливера Измельчительно-режущее оборудование, Пушкарева
Измельчительно-режущее оборудование, Пушкарева Скоро в школу! Полезная информация для родителей будущих первоклассников
Скоро в школу! Полезная информация для родителей будущих первоклассников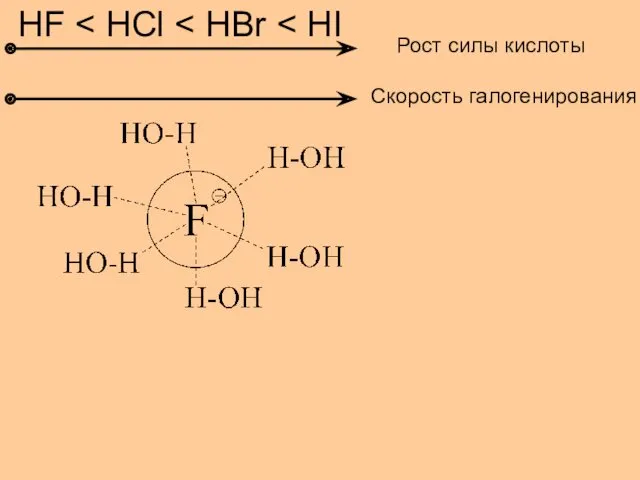 Алкены
Алкены Ленталы конвейрдің автоматтандырылған электр жетегін өңдеу
Ленталы конвейрдің автоматтандырылған электр жетегін өңдеу Политическая культура
Политическая культура Духовная культура
Духовная культура РЯ 5 класс №8
РЯ 5 класс №8 Моноклонды антиденелер (МКАД). Гибридомды технология.МКАД иммунологияда негізгі қолдану аймағы
Моноклонды антиденелер (МКАД). Гибридомды технология.МКАД иммунологияда негізгі қолдану аймағы Пословицы и поговорки. Народные приметы. Осенние загадки. Инсценирование произведения Н. Сладкова Осень
Пословицы и поговорки. Народные приметы. Осенние загадки. Инсценирование произведения Н. Сладкова Осень Бумага
Бумага Три стихии в один день
Три стихии в один день Электронная система зажигания
Электронная система зажигания Продуктивные виды письменной работы
Продуктивные виды письменной работы Без сомненья, все наши знания начинаются с опыта
Без сомненья, все наши знания начинаются с опыта Ядерно физические методы определения возраста археологических находок
Ядерно физические методы определения возраста археологических находок О рассмотрении паспорта проекта Модернизация ТГ-6 с заменой проточной части цилиндра среднего давления (ЦСД)
О рассмотрении паспорта проекта Модернизация ТГ-6 с заменой проточной части цилиндра среднего давления (ЦСД) Правоотношения в сфере туризма
Правоотношения в сфере туризма Мясные субпродукты
Мясные субпродукты Травматология детского возраста
Травматология детского возраста Новшества законодательства для бухгалтера
Новшества законодательства для бухгалтера Гендік модифицирленген өнім
Гендік модифицирленген өнім Частотный критерий устойчивости Найквиста. Запасы устойчивости ЛСС (лекция 6)
Частотный критерий устойчивости Найквиста. Запасы устойчивости ЛСС (лекция 6) Клинические проявления короновирусной инфекции COVID-19
Клинические проявления короновирусной инфекции COVID-19 Право в системе социальных норм
Право в системе социальных норм