Содержание
- 2. немецкий педагог, либеральный политик. Выступал за секуляризацию школ. В 1812—20 годах преподавал физику и математику в
- 3. Проверка д/з: Задача 1. Установите формулу вещества, содержащего 62,06% углерода, 10,35% водорода и 27,59% некоторого элемента,
- 4. Решение задачи 1 Mr(CxHyЭz)=2Dвозд.=2x29=58 W(х.э.)=nAr/Mr n= WMr/Ar X=0,6206x58/12=3 Y=0,1035x58/1=6 12x3 + 6 +nAr(Э)=58 nAr(Э)=58-42=16, следовательно Э
- 5. Решение задачи 2
- 6. Цель урока: обобщение и систематизация изученного материала об альдегидах и кетонах в соответствии со спецификацией КИМов
- 7. Задачи урока: осуществить повторение, закрепление и обобщение сведений о составе, строении, характерных химических свойствах и способах
- 8. Тема урока: ОБОБЩЕНИЕ И СИСТЕМАТИЗАЦИЯ ЗНАНИЙ О КАРБОНИЛЬНЫХ СОЕДИНЕНИЯХ
- 9. План урока: Гомология, изомерия, номенклатура альдегидов и кетонов (А13). Характерные химические свойства альдегидов (А16, В7). Основные
- 10. Этап 1. Гомология, изомерия, номенклатура альдегидов и кетонов. А1.
- 11. А2
- 12. А3. Формула альдегида: 1) СН3СООН 2 ) СН3СНО 3) СН3СОСН3 4) С2Н5ОН А4. Формула кетона: 1)СН3СОСН3
- 13. А5
- 14. А6
- 15. А7. Метаналь и формальдегид являются: 1) гомологами 2) структурными изомерами 3) геометрическими изомерами 4) одним и
- 16. А9. Пропаналь и пропанон – это: 1) гомологи 2) изомеры 3) таутомеры 4) одно и то
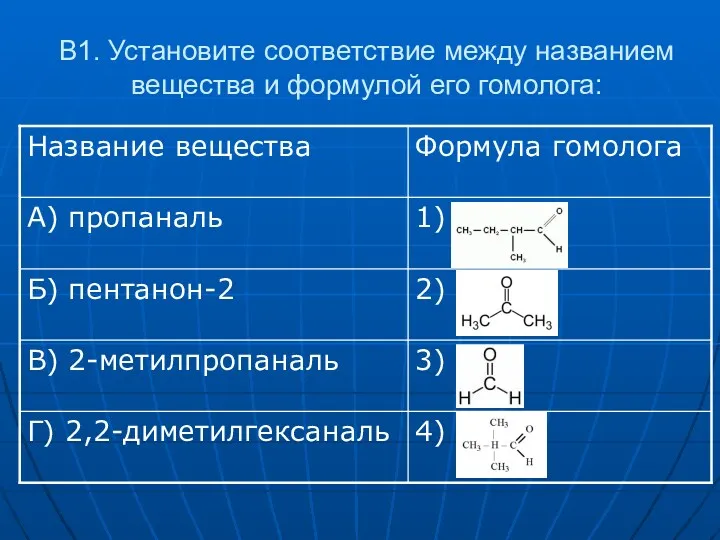
- 17. В1. Установите соответствие между названием вещества и формулой его гомолога:
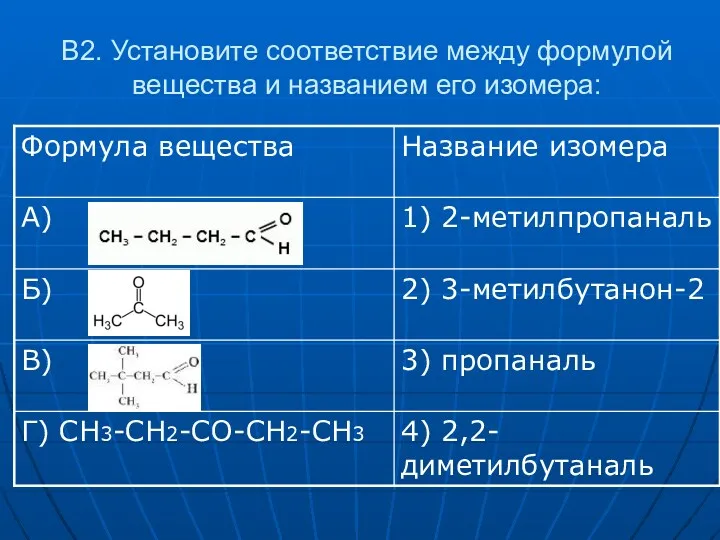
- 18. В2. Установите соответствие между формулой вещества и названием его изомера:
- 19. Этап 2. Характерные химические свойства альдегидов В1. Для альдегидов характерны реакции: 1) гидрирования 2) дегидратации 3)
- 20. А1.Формальдегид реагирует с: 1) гидроксидом меди (II) 2) уксусной кислотой 3) гексаном 4) Алюминием А2. При
- 21. А4. При восстановлении пропаналя получается: 1) пропановая кислота 2) пропанол-1 3) 2-метилпропаналь 4) дипропиловый эфир А5.
- 22. А7. Этаналь вступает в реакцию присоединения с: 1) гидроксидом меди (II) 2) водородом 3) кислородом 4)
- 23. Этап 3. Основные способы получения альдегидов в лаборатории А1. Этаналь можно получить из этанола посредством реакции:
- 24. А3. При окислении метанола оксидом меди (II) образуется: 1) метан 2) уксусная кислота 3) метаналь 4)
- 25. Этап 4. Взаимосвязь карбонильных соединений с другими веществами А1. Определите вещество Х в следующей схеме превращений:
- 26. А2. Определите вещество У в следующей схеме превращений: H2O, Hg2+ Х H2,Ni,t У 1) этиловый спирт
- 27. Выполни дома 1или более цепочек превращений
- 29. Скачать презентацию
























 Буддизм в России
Буддизм в России Проект Подарок маме презентация
Проект Подарок маме презентация Готовность сельской базовой школы к реализации ФГОс
Готовность сельской базовой школы к реализации ФГОс Европейские нормативы теплозащиты зданий. Технологии теплозащиты и естественной вентиляции архитектурных сооружений в Казахстане
Европейские нормативы теплозащиты зданий. Технологии теплозащиты и естественной вентиляции архитектурных сооружений в Казахстане Ценообразование в условиях монополии
Ценообразование в условиях монополии Музика античності
Музика античності Серебро. Текущая динамика и перспективы на 2021 г
Серебро. Текущая динамика и перспективы на 2021 г Учитель года России-2016
Учитель года России-2016 Внеклассное мероприятие для младших школьников. День Петра и Февронии
Внеклассное мероприятие для младших школьников. День Петра и Февронии Информация для размышления Вредные привычки.
Информация для размышления Вредные привычки. Костюмы в стиле Стимпанк
Костюмы в стиле Стимпанк Побочные эффекты антипсихотических препаратов
Побочные эффекты антипсихотических препаратов Сергиев Посад
Сергиев Посад Изоляция газопровода
Изоляция газопровода Алгебра высказываний. Решение логических задач
Алгебра высказываний. Решение логических задач Почки. Опухоль правой почки больших размеров
Почки. Опухоль правой почки больших размеров Перелетные птицы.
Перелетные птицы. Конституция РФ – гарант свобод и прав народных
Конституция РФ – гарант свобод и прав народных презентация проекта Мастерская Самоделкина
презентация проекта Мастерская Самоделкина Профориентационные мероприятия школьников
Профориентационные мероприятия школьников Организация междугородных автобусных перевозок
Организация междугородных автобусных перевозок AROMAgroup. Рекомендованные ароматы
AROMAgroup. Рекомендованные ароматы Роторный экскаватор
Роторный экскаватор Строительные материалы. Строение и основные свойства строительных материалов
Строительные материалы. Строение и основные свойства строительных материалов Градация лекал деталей одежды
Градация лекал деталей одежды Сексуалды мәдениет. Денсаулығында ақауы бар индивидтерді тұлға түрінде гигеналық және жыныстық тәрбиелеу әлеуметтік үрдіс
Сексуалды мәдениет. Денсаулығында ақауы бар индивидтерді тұлға түрінде гигеналық және жыныстық тәрбиелеу әлеуметтік үрдіс Общая характеристика элементов главной подгруппы II группы.
Общая характеристика элементов главной подгруппы II группы. Китайская Народная Республика в 1949-2007 г.г
Китайская Народная Республика в 1949-2007 г.г