Содержание
- 2. Обратимые и необратимые реакции Необратимыми называют химические реакции, протекающие только в одном направлении. Обратимыми называют реакции,
- 3. Обратимые и необратимые реакции При каких условиях данная реакция будет обратимой? Необратимой?
- 4. Химическое равновесие Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
- 5. Смещение химического равновесия Принцип Ле Шателье (1884г.): если на систему, находящуюся в равновесии, оказывается внешнее воздействие,
- 6. Влияние изменения температуры
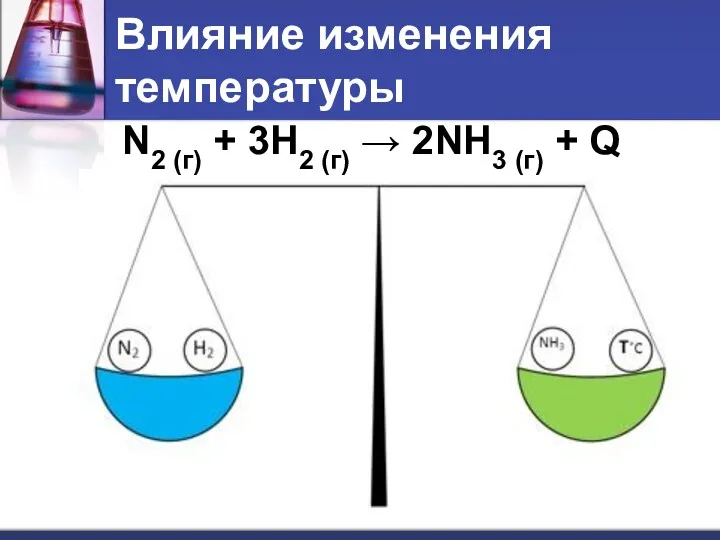
- 7. Влияние изменения температуры N2 (г) + 3H2 (г) → 2NH3 (г) + Q
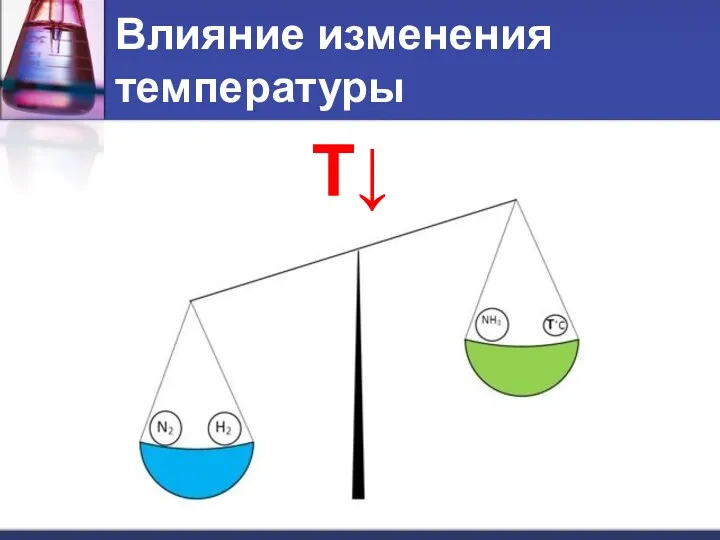
- 8. Влияние изменения температуры T↓
- 9. При повышении температуры равновесие смещается в сторону эндотермической реакции. При понижении температуры – в сторону экзотермической
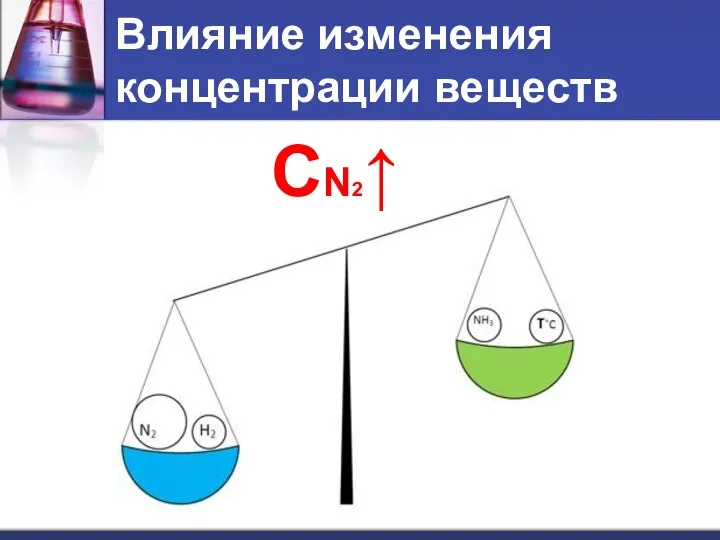
- 10. Влияние изменения концентрации веществ СN2↑
- 11. Влияние изменения концентрации веществ При увеличении концентрации одного из веществ равновесие смещается в сторону его расходования.
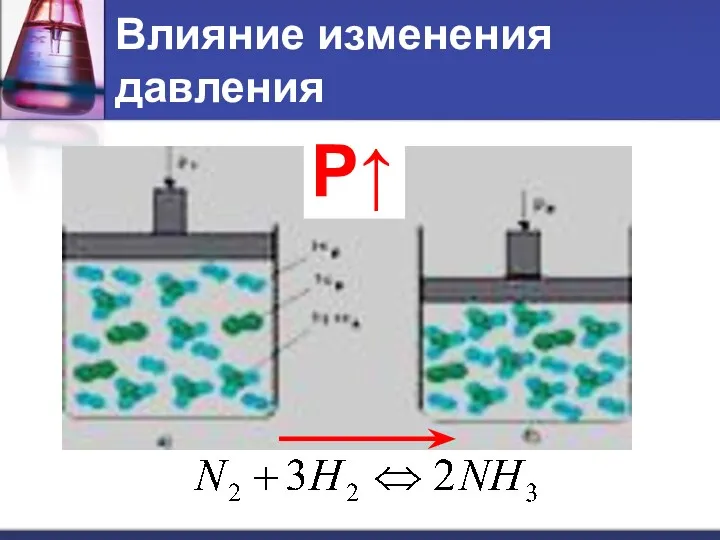
- 12. Влияние изменения давления Р↑
- 13. Влияние изменения давления При увеличении давления равновесие смещается в сторону той реакции, при которой объем образующихся
- 14. Катализатор: не влияет на смещение химического равновесия (он лишь ускоряет процесс его достижения)
- 16. Скачать презентацию








 язык худ.лит
язык худ.лит презентация к сообщению Музыкально-театрализованная деятельность детей раннего возраста
презентация к сообщению Музыкально-театрализованная деятельность детей раннего возраста Презентация к классному часу Маскарад вредных привычек
Презентация к классному часу Маскарад вредных привычек Техническое обслуживание аппаратуры управления электромагнитного типа. Судовые нагревательные приборы. (Билет 27)
Техническое обслуживание аппаратуры управления электромагнитного типа. Судовые нагревательные приборы. (Билет 27) 10 Путешествие в страну Грамота (звуки Ф, Фь. Буква Ф)
10 Путешествие в страну Грамота (звуки Ф, Фь. Буква Ф) Установление парламентской монархии в Англии
Установление парламентской монархии в Англии Праздничный сладкий стол
Праздничный сладкий стол Духовная культура. Роль религии в жизни общества
Духовная культура. Роль религии в жизни общества Презентация Мой любимый детский сад!
Презентация Мой любимый детский сад! Л.Н. Толстой 1828-1910
Л.Н. Толстой 1828-1910 День семьи, любви и верности
День семьи, любви и верности Разработка по теме: Детский суицид
Разработка по теме: Детский суицид ашамлыклар темасы буенча презентация
ашамлыклар темасы буенча презентация Управление кредитным портфелем коммерческого банка
Управление кредитным портфелем коммерческого банка Системы счисления. Древние системы счисления
Системы счисления. Древние системы счисления История телевидения
История телевидения Религия как одна из форм культуры
Религия как одна из форм культуры Презентация Угадай словечко (двусложные слова с открытым слогом)
Презентация Угадай словечко (двусложные слова с открытым слогом) Our energy saving plan
Our energy saving plan Колониальная политика европейских стран
Колониальная политика европейских стран Одежда для активного отдыха и занятий зимними видами спорта
Одежда для активного отдыха и занятий зимними видами спорта ПРАВА РЕБЕНКА
ПРАВА РЕБЕНКА Презентация С Днем защитника Отечества!
Презентация С Днем защитника Отечества! Ключевые учебно - познавательные компетенции
Ключевые учебно - познавательные компетенции Бонавентуре Кавальери (1598 – 1647)
Бонавентуре Кавальери (1598 – 1647) Масленица
Масленица Эксплуатация нефтяных скважин погружными центробежными электронасосами. Общая схема установки, ее элементы и их назначение
Эксплуатация нефтяных скважин погружными центробежными электронасосами. Общая схема установки, ее элементы и их назначение Русская матрешка
Русская матрешка