Содержание
- 2. План 1. Признаки объектов коллоидной химии и количественные характеристики дисперсных систем 2. Классификация дисперсных систем 3.Методы
- 3. Коллоидная химия – это наука о поверхностных явлениях и физико-химических свойствах дисперсных систем.
- 4. Фаза – совокупность частей системы тождественных по составу и термодинамическим свойствам. Вещество, распределенное в виде отдельных
- 5. Вещество, в котором распределена дисперсная фаза – дисперсионной средой. Дисперсная фаза нерастворима в дисперсионной среде и
- 6. Система, в которой одно вещество раздроблено и распределено в массе другого вещества, называется дисперсной системой.
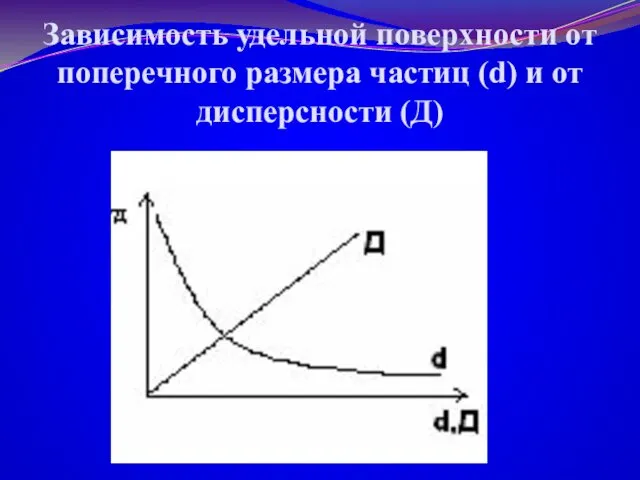
- 7. Количественные характеристики дисперсных систем 1.Поперечный размер частиц (ø, ребро куба) – d; [d]=см, м 2.Дисперсность (Д)
- 8. Зависимость удельной поверхности от поперечного размера частиц (d) и от дисперсности (Д)
- 10. Классификация дисперсных систем
- 11. I. По степени дисперсности дисперсной фазы 1. Грубодисперсные системы >10-7 м или >100 нм 2. Коллоидно-дисперсные
- 12. 2.По степени взаимодействия между частицами дисперсной фазы Свободнодисперсные – частицы не связаны, это системы, обладающие текучестью,
- 13. 3. По взаимодействию между дисперсной фазой и дисперсионной средой (для жидкой среды) Системы с интенсивным взаимодействием
- 14. 4. По агрегатному состоянию
- 15. Методы получения дисперсных систем Диспергационные (вещества тонко измельчаются – диспергируют в состав дисперсионной среды) Конденсационные (коллоидное
- 16. Диспергационные методы 1.Механическое дробление (все природные коллоидные системы). 2.Ультрозвуковое дробление 3.Электрическое дробление 4.Химическое дробление – пептизация
- 17. Конденсационные методы А.Физические 1.Конденсация пара в газовой среде (туман). 2.Конденсация пара в жидкости (ртуть в холодной
- 18. Конденсационные методы Б.Химические (называются по типу химической реакции) 1.Восстановление 2HAuCl4 + 3H2O2 → 2Au + 8HCl
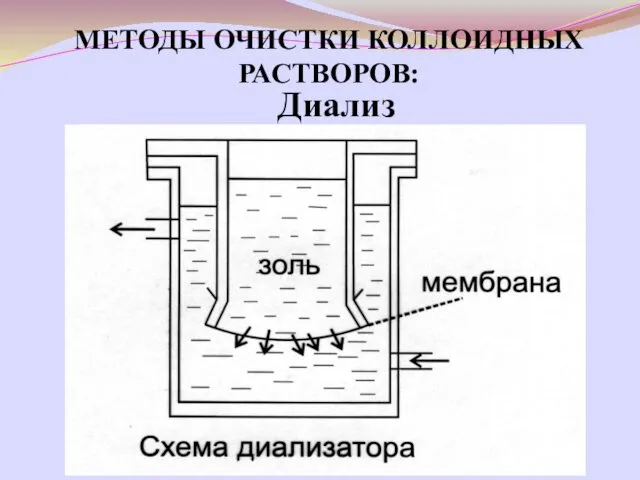
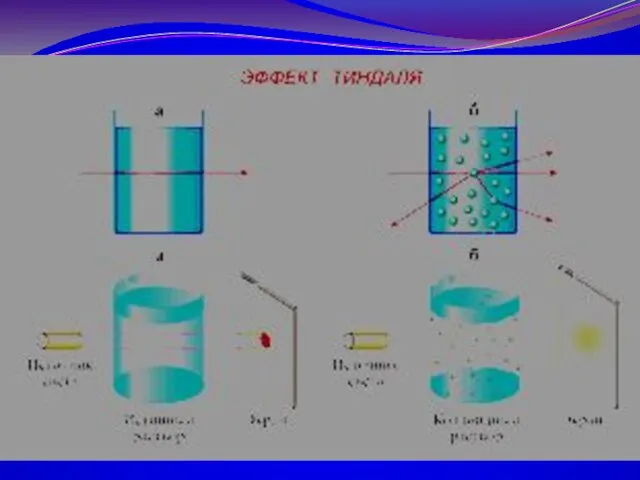
- 19. МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ: Диализ
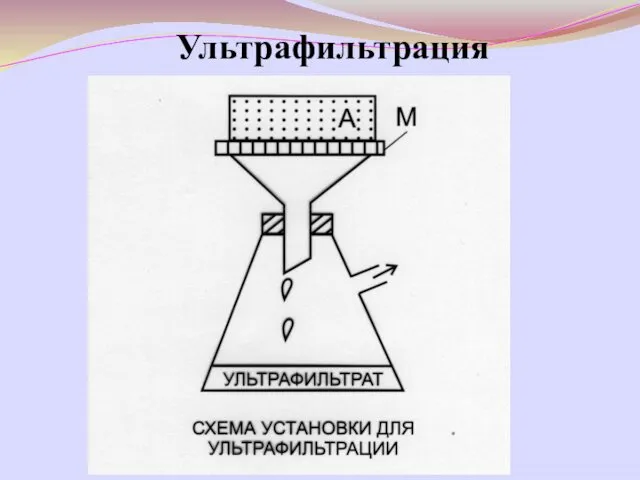
- 20. Ультрафильтрация
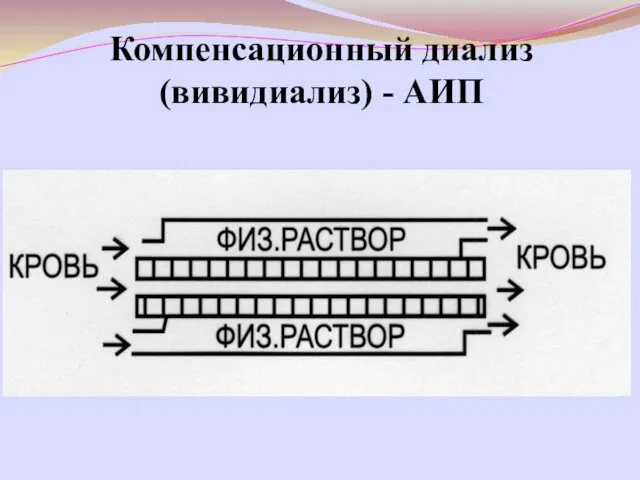
- 21. Компенсационный диализ (вивидиализ) - АИП
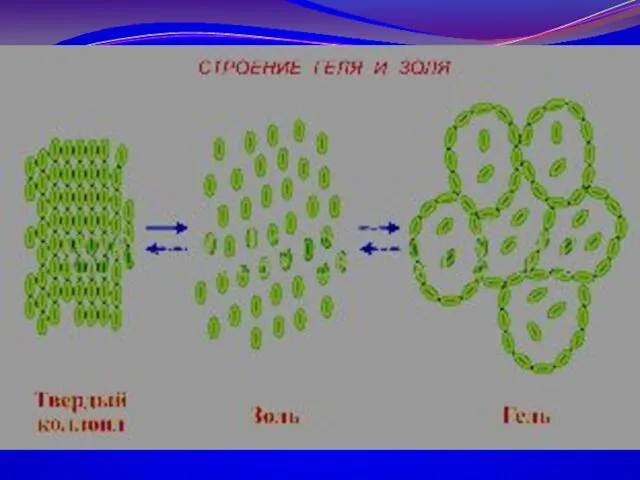
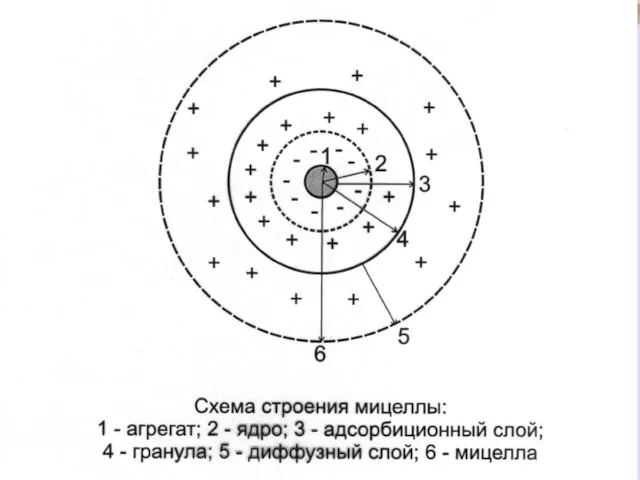
- 22. МИЦЕЛЛА (Лат. Mica -крошка) - это отдельная частица дисперсной фазы коллоидного раствора с жидкой дисперсионной средой.
- 23. Ядро состоит из агрегата (микрокристаллы малорастворимого вещества) и потенциалопределяющих ионов (ПОИ). Мицелла состоит из: 1. ядра;
- 26. Схема строения коллоидной мицеллы золя
- 27. Правило ПАНЕТТА-ФАЯНСА: кристаллическую решетку ядра достраивает тот ион, который находится в растворе в избытке и содержится
- 28. Условия получения золя: 1. плохая растворимость Д.Ф. в Д.С., т.е. наличие границы раздела фаз; 2. размер
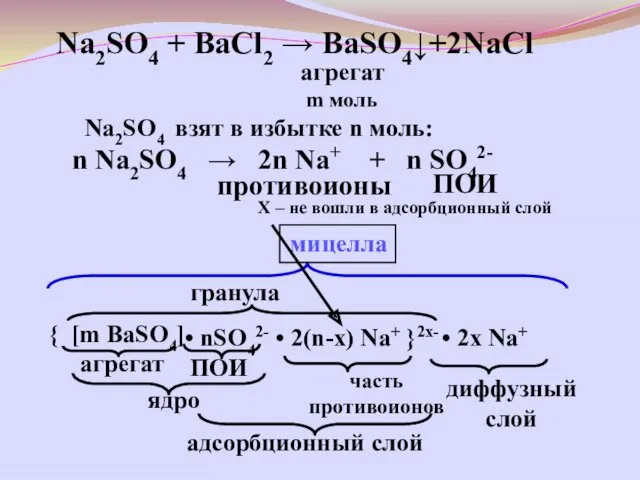
- 29. агрегат m моль Na2SO4 взят в избытке n моль: n Na2SO4 → 2n Na+ + n
- 30. BaCl2 взят в избытке n моль; n BaCl2 → n Ba2+ + n 2Cl- противоионы ПОИ
- 31. В мицелле существует 2 скачка потенциала: 1) φ - электротермодинамический – φ ~ 1 В. 2)
- 32. Электрокинетический или дзета- потенциал (ξ-потенциал) возникает между гранулой и диффузным слоем, т. е. между неподвижной и
- 33. Электрокинетические явления: ∙Электрофорез – это движение частиц дисперсной фазы в электрическом поле к противоположно заряженному электроду.
- 35. Устойчивость коллоидных растворов
- 36. Кинетическая устойчивость связана со способностью частиц дисперсной фазы к самопроизвольному тепловому движению в растворе, которое известно
- 37. Агрегатная устойчивость обусловлена тем, что на поверхности коллоидных частиц имеет место адсорбции ионов из окружающей среды.
- 38. Седиментационная (кинетическая) устойчивость - Критерии: броуновское движение; степень дисперсности; 3. вязкость дисперсионной среды (чем ↑, тем
- 39. II. Агрегативная устойчивость – способность системы противостоять слипанию частиц дисперсной фазы. Критерии: 1. ионная оболочка, т.е.
- 40. Основные факторы устойчивости коллоидных растворов 1. Величина ζ-потенциала 2. Величина электродинамического потенциала (φ) 3. Толщина диффузного
- 41. Факторы, вызывающие коагуляцию: увеличение концентрации золя; действие света; изменение температуры; облучение; добавление электролитов. КОАГУЛЯЦИЯ – процесс
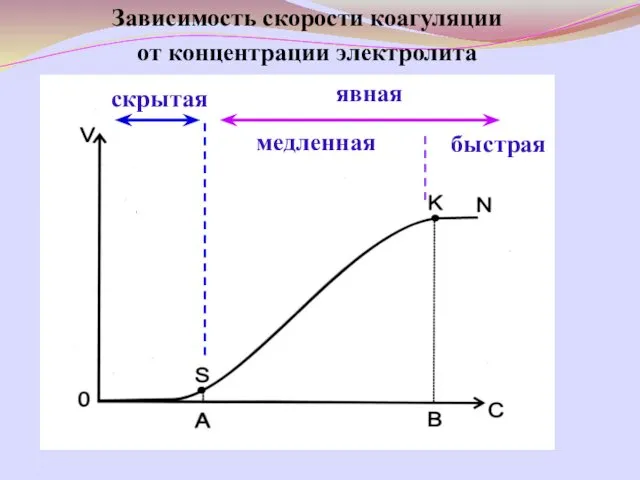
- 42. Зависимость скорости коагуляции от концентрации электролита скрытая явная медленная быстрая
- 43. наименьшее количество электролита, которое вызывает явную коагуляцию 1л золя γ = C· V / Vо γ
- 44. Правило Шульце-Гарди: Для разновалентных ионов их коагулирующее действие прямо пропорционально зарядам ионов в шестой степени
- 45. Р(Al+3) : Р(Ca+2) : Р(K+1) ≈ Гранула ( - ) 36 : 26 : 16 ≈
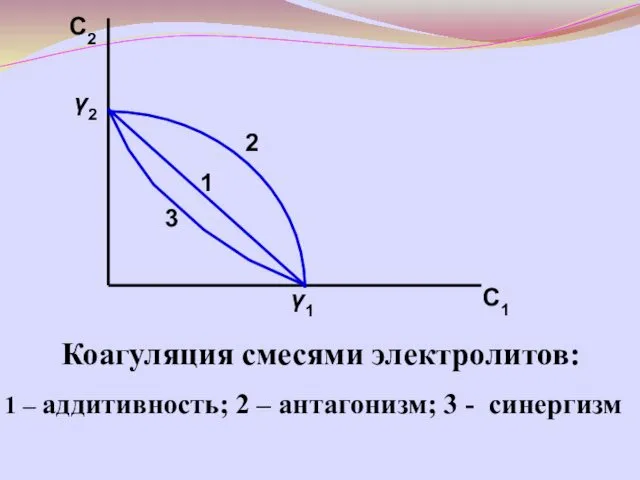
- 46. При коагуляции смесями электролитов возможны 3 случая: 1) аддитивность – 2) антагонизм – 3) синергизм –
- 47. C2 C1 2 1 3 γ2 γ1 Коагуляция смесями электролитов: 1 – аддитивность; 2 – антагонизм;
- 48. Механизм коагуляции золей электролитами 1. Сжатие диффузного слоя 2. Избирательная адсорбция ионов с зарядом, противоположным заряду
- 49. Защита коллоидов от коагуляции Устойчивость коллоидов к действию электролитов повышается при добавлении к ним ВМС (белков,
- 50. Коллоидное серебро представляет собой коллоидный раствор сверхмалых частиц серебра, находящихся во взвешенном состоянии. Коллоидное Серебро помогает
- 51. Коллоидный раствор наночастиц золота в воде
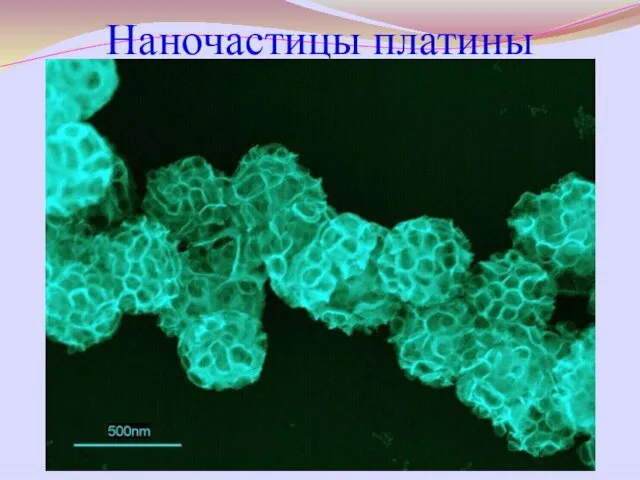
- 52. Наночастицы платины
- 53. Спасибо за внимание!
- 55. Скачать презентацию









































 Специальное воспитание и образование детей с ОВЗ
Специальное воспитание и образование детей с ОВЗ Основы управления
Основы управления урок иван сусанин 03
урок иван сусанин 03 Альтернативная елочка из капроновой сетки
Альтернативная елочка из капроновой сетки Заповеди блаженства. Катехизис свт. Филарета. О пятой заповеди Блаженства
Заповеди блаженства. Катехизис свт. Филарета. О пятой заповеди Блаженства Азбука абитуриента
Азбука абитуриента Четвёртый лишний
Четвёртый лишний Сортировка и поиск данных в электронных таблицах
Сортировка и поиск данных в электронных таблицах Ткань. Виды ткани.
Ткань. Виды ткани. Развитие речи детей старшего дошкольного возраста в сюжетно-ролевой игре
Развитие речи детей старшего дошкольного возраста в сюжетно-ролевой игре ДПИ Японии. Японская керамика
ДПИ Японии. Японская керамика Методика организации подвижных игр в ДОУ
Методика организации подвижных игр в ДОУ Презентация Роль методов и приемов арт терапии в оздоровлении детей с речевыми нарушениями
Презентация Роль методов и приемов арт терапии в оздоровлении детей с речевыми нарушениями The United Kingdom of Great Britain and Northern Ireland
The United Kingdom of Great Britain and Northern Ireland Основні положення ЗУ Про акредитацію органів з оцінки відповідності
Основні положення ЗУ Про акредитацію органів з оцінки відповідності Лёгкая промышленнсть
Лёгкая промышленнсть Иммунология и иммунодиагностика. СПИД
Иммунология и иммунодиагностика. СПИД Клятвы на новый год
Клятвы на новый год Экстрасистолия.Жыбыр аритмиясы
Экстрасистолия.Жыбыр аритмиясы Воспитание
Воспитание Смешанные и широколиственные леса
Смешанные и широколиственные леса Задачи на встречное движение
Задачи на встречное движение Belfast is the capital and the largest city of Northern Ireland
Belfast is the capital and the largest city of Northern Ireland Школа молодого педагога. Что сделать до начала учебного года. Документы воспитателя
Школа молодого педагога. Что сделать до начала учебного года. Документы воспитателя Сумочка из цветной бумаги и картона
Сумочка из цветной бумаги и картона Viva Vet. Средства по уходу за животными
Viva Vet. Средства по уходу за животными Числовые ребусы
Числовые ребусы Таблица-сравнение видеокарт
Таблица-сравнение видеокарт