Содержание
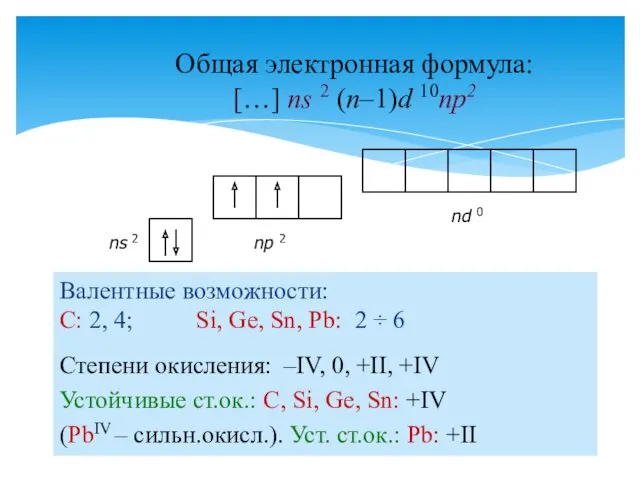
- 2. Валентные возможности: С: 2, 4; Si, Ge, Sn, Pb: 2 ÷ 6 Общая электронная формула: […]
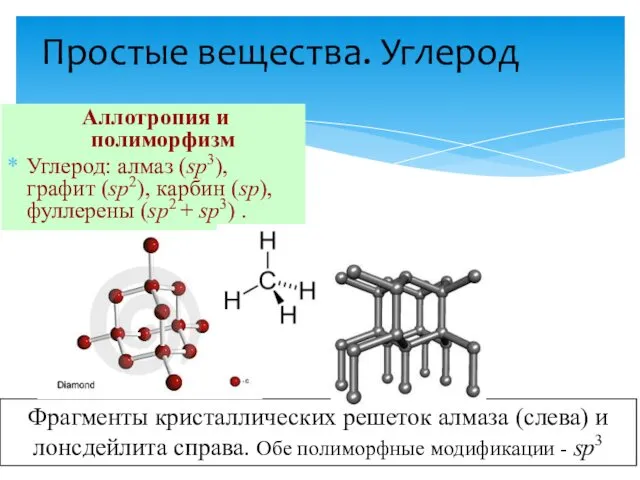
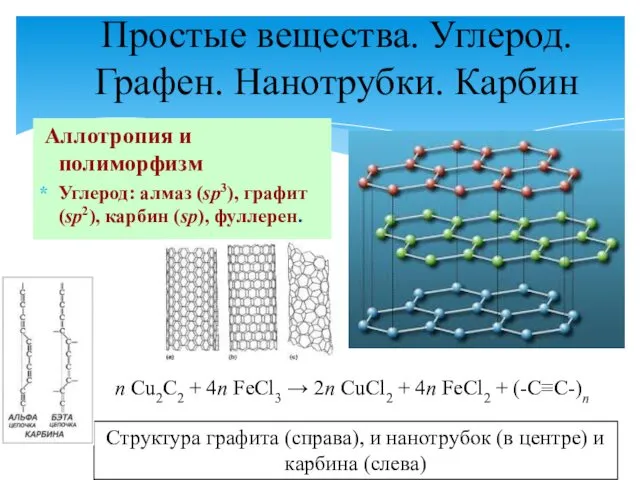
- 3. Простые вещества. Углерод Аллотропия и полиморфизм Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерены (sp2 +
- 4. Алмаз Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см3. Крист. решетка атомная (sp3-гибридизация).
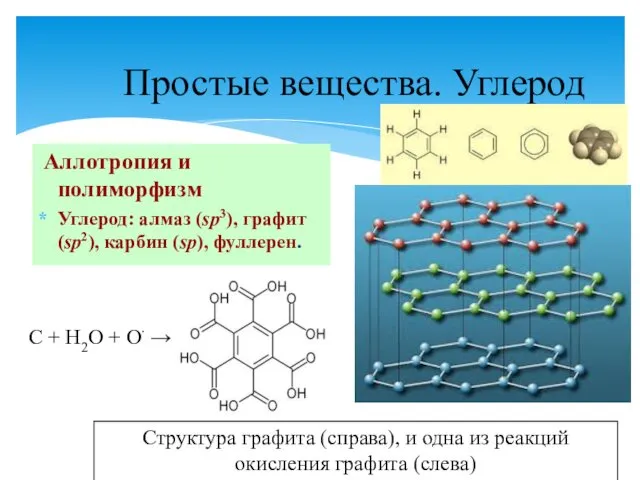
- 5. Простые вещества. Углерод Аллотропия и полиморфизм Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Структура графита
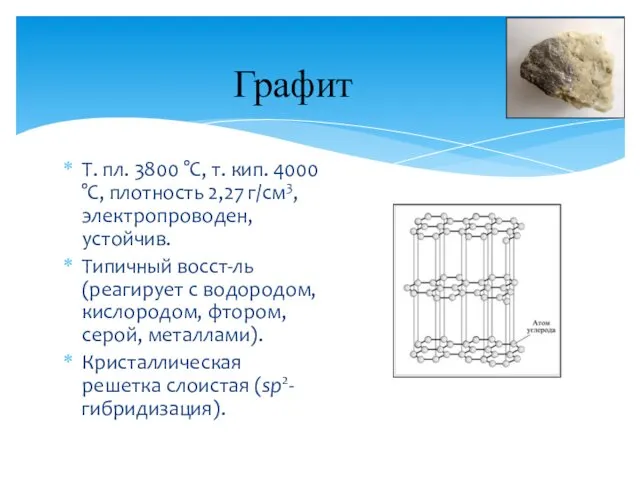
- 6. Графит Т. пл. 3800 °С, т. кип. 4000 °С, плотность 2,27 г/см3, электропроводен, устойчив. Типичный восст-ль
- 7. Простые вещества. Углерод. Графен. Нанотрубки. Карбин Аллотропия и полиморфизм Углерод: алмаз (sp3), графит (sp2), карбин (sp),
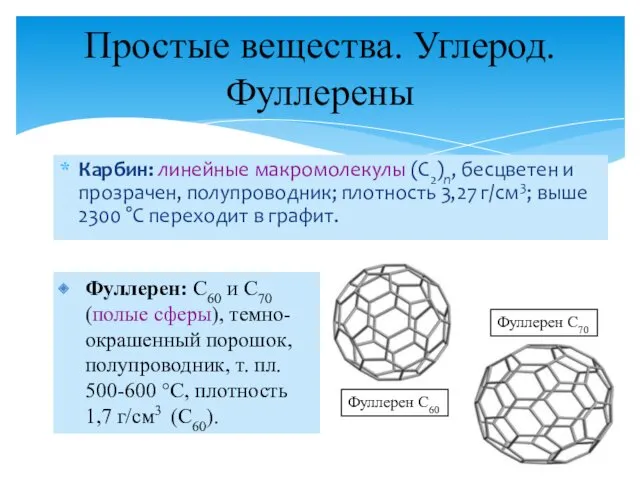
- 8. Простые вещества. Углерод. Фуллерены Аллотропия и полиморфизм Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Структура
- 9. Карбин: линейные макромолекулы (С2)n, бесцветен и прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300 °С переходит в
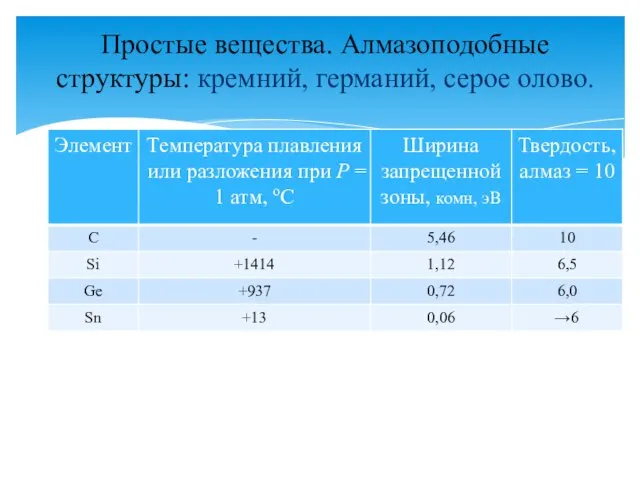
- 10. Простые вещества. Алмазоподобные структуры: кремний, германий, серое олово.
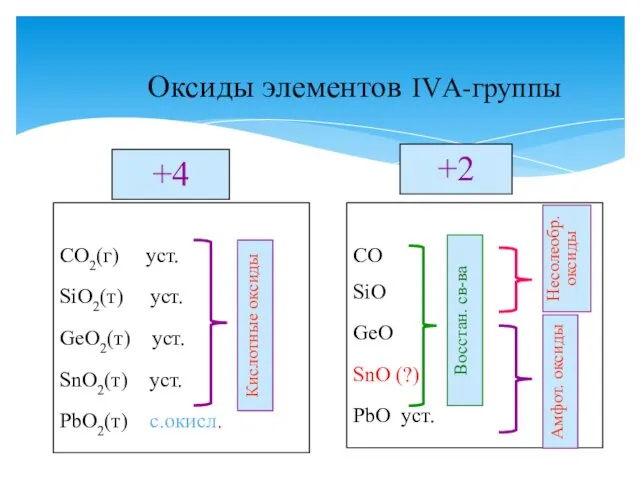
- 11. Оксиды элементов IVА-группы +4 CO2(г) уст. SiO2(т) уст. GeO2(т) уст. SnO2(т) уст. PbO2(т) с.окисл. +2 CO
- 12. Высшие кислородные соединения. Диоксид углерода CO2 (кислотный оксид) Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим
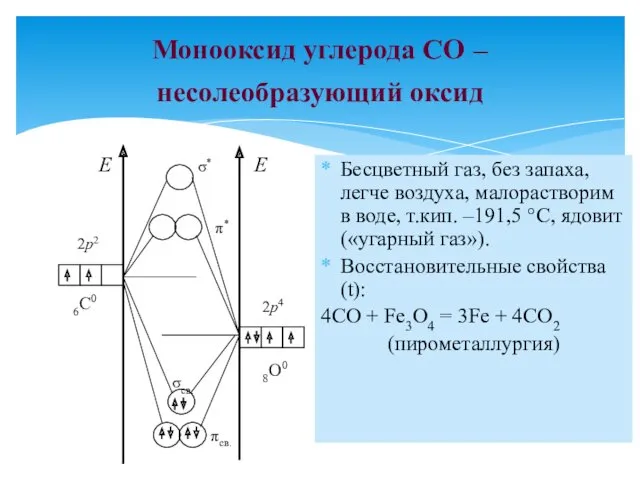
- 13. Монооксид углерода CO – несолеобразующий оксид Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, т.кип.
- 14. Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5]. Монооксид углерода CO : C ::: O Обнаружение:
- 15. Некоторое отступление. Несколько слов о кристаллах… Трансляционная симметрия кристалла Свойства симметрии идеальных кристаллов проявляются в следующем.
- 16. Некоторое отступление. Несколько слов о кристаллах… Трансляционная симметрия кристалла Параллелепипед, имеющий в качестве ребер векторы a,
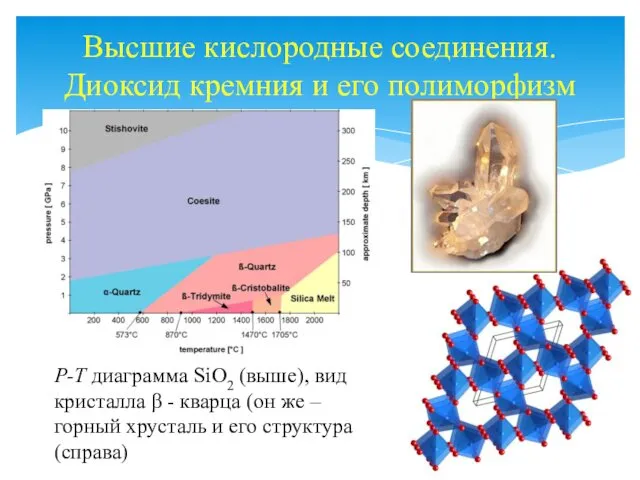
- 17. Высшие кислородные соединения. Диоксид кремния и его полиморфизм P-T диаграмма SiO2 (выше), вид кристалла β -
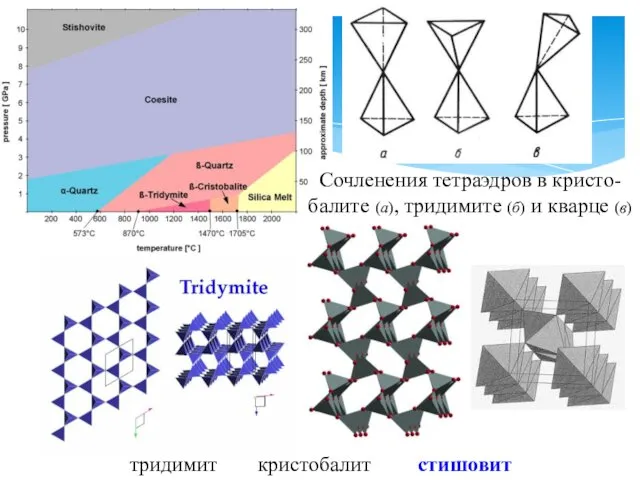
- 18. тридимит кристобалит стишовит Сочленения тетраэдров в кристо-балите (а), тридимите (б) и кварце (в)
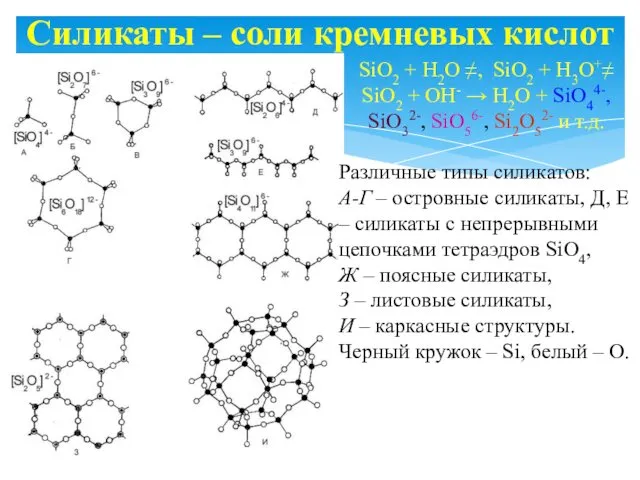
- 19. Силикаты – соли кремневых кислот SiO2 + H2O ≠, SiO2 + H3O+≠ SiO2 + OH- →
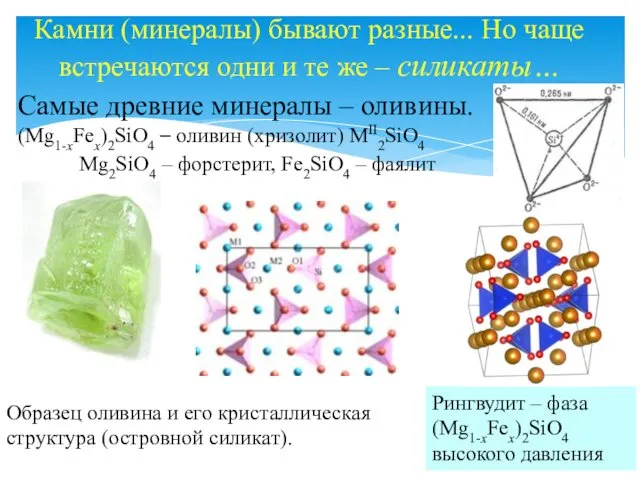
- 20. Камни (минералы) бывают разные... Но чаще встречаются одни и те же – силикаты… Самые древние минералы
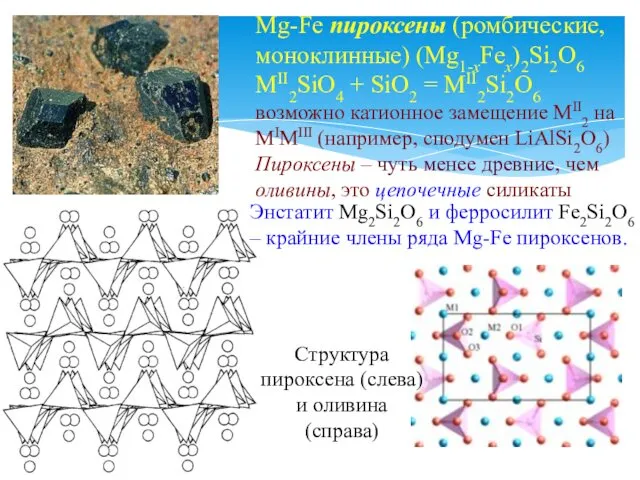
- 21. Mg-Fe пироксены (ромбические, моноклинные) (Mg1-xFex)2Si2O6 MII2SiO4 + SiO2 = MII2Si2O6 возможно катионное замещение MII2 на MIMIII
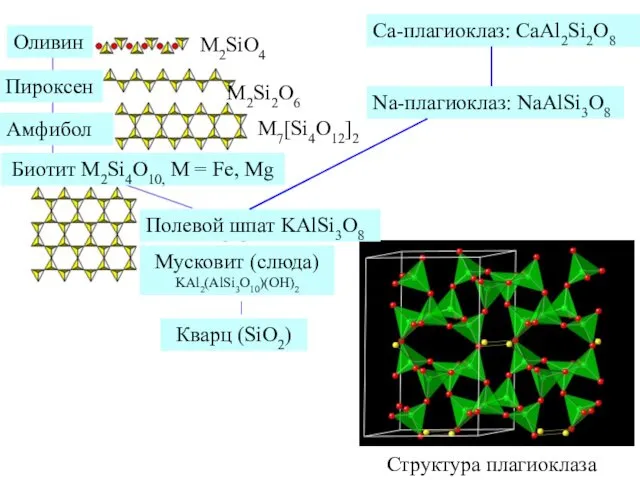
- 22. M2Si2O6 M2SiO4 Оливин Пироксен Амфибол Полевой шпат KAlSi3O8 Мусковит (слюда) KAl2(AlSi3O10)(OH)2 Кварц (SiO2) Структура плагиоклаза |
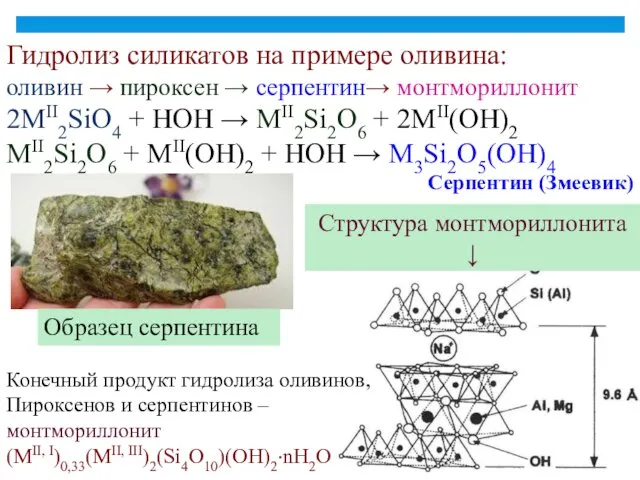
- 23. Структура монтмориллонита ↓ Гидролиз силикатов на примере оливина: оливин → пироксен → серпентин→ монтмориллонит 2MII2SiO4 +
- 24. Промежуточный итог: у минералов (твердых фаз) своя эволюция. В частности, для силикатов: Самые древние силикаты –
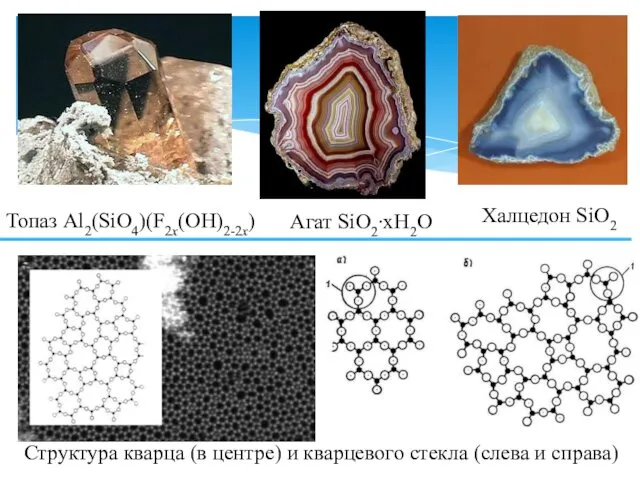
- 25. Топаз Al2(SiO4)(F2x(OH)2-2x) Агат SiO2∙xH2O Халцедон SiO2 Структура кварца (в центре) и кварцевого стекла (слева и справа)
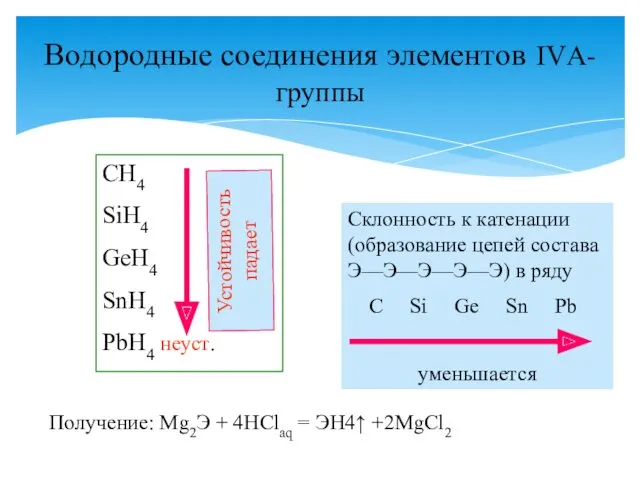
- 26. Водородные соединения элементов IVА-группы СH4 SiH4 GeH4 SnH4 PbH4 неуст. Склонность к катенации (образование цепей состава
- 27. Химические свойства При комн. темп. С, Si, Ge + H2O ≠ С, Si, Ge + H3O+
- 28. С(т) + KOH ≠ Si + 4NaOH = Na4SiO4 + 2H2↑ Si + 8OH– –4e –
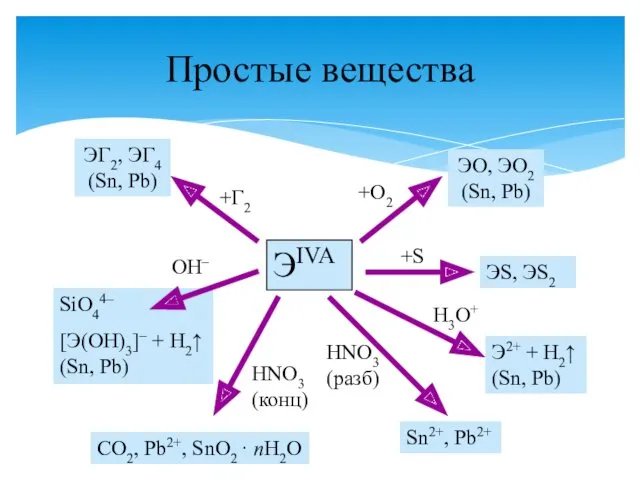
- 29. Простые вещества ЭIVA ЭГ2, ЭГ4 (Sn, Pb) ЭO, ЭO2 (Sn, Pb) ЭS, ЭS2 SiO44– [Э(OH)3]– +
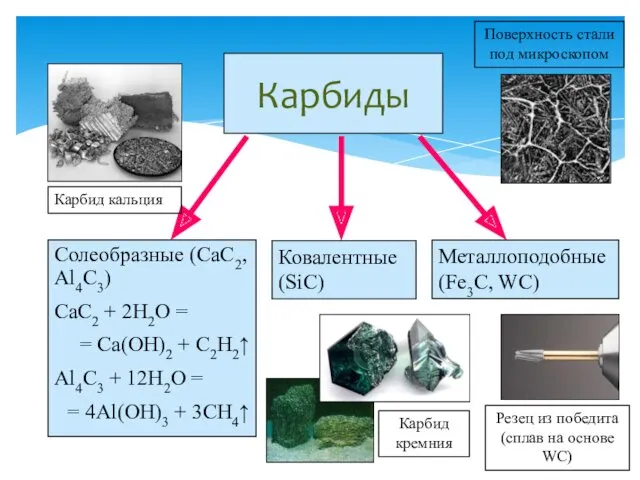
- 30. Карбиды
- 31. Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO↑ + 8H2O Si + 4NaOH
- 32. Моносилан SiH4: SiH4 + 2O2 = SiO2 + 2H2O Получение силанов: SiO2 + 4Mg(изб) = Mg2Si
- 33. Травление стекла SiO2 + 4HF = SiF4↑ + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] +
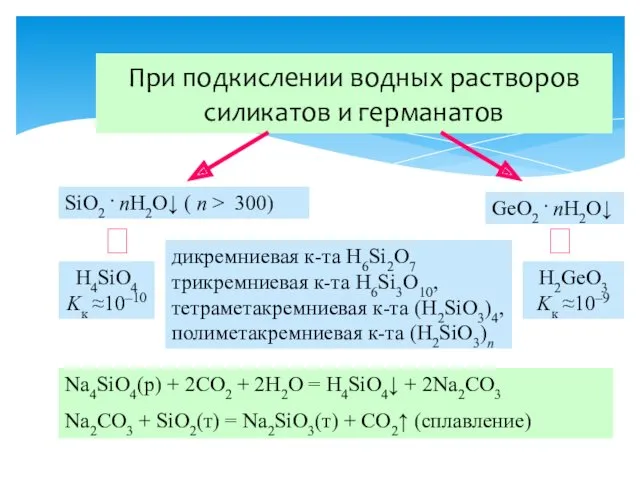
- 34. При подкислении водных растворов силикатов и германатов SiO2 . nH2O↓ ( n > 300) дикремниевая к-та
- 36. Скачать презентацию



![Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5]. Монооксид углерода](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/35413/slide-13.jpg)





![Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/35413/slide-30.jpg)


 М.А. Булгаков Мастер и Маргарита. История создания, сюжет, композиция, герои
М.А. Булгаков Мастер и Маргарита. История создания, сюжет, композиция, герои Терроризм - главная угроза человечеству
Терроризм - главная угроза человечеству Electric properties of biological objects
Electric properties of biological objects Модернизация двухвального смесителя для приготовления бетона БП-2Г-750
Модернизация двухвального смесителя для приготовления бетона БП-2Г-750 Навыки персональной безопасности
Навыки персональной безопасности Международная экономическая летняя школа
Международная экономическая летняя школа Формирование навыков безопасного поведения обучающихся посредством изучения курса Азбука пешехода
Формирование навыков безопасного поведения обучающихся посредством изучения курса Азбука пешехода Экологический фестиваль Заповедник времен
Экологический фестиваль Заповедник времен Книга Руфь
Книга Руфь Covid-19 у детей. Вопросы лечения
Covid-19 у детей. Вопросы лечения Электронные таблицы (ЭТ)
Электронные таблицы (ЭТ) School days
School days презентация Заботимся о книгах Диск
презентация Заботимся о книгах Диск Биоадаптивная оболочка здания
Биоадаптивная оболочка здания Мать - это женщина, которая......
Мать - это женщина, которая...... Well Completion & Stimulation. Chapter 6
Well Completion & Stimulation. Chapter 6 PP PEC_Holders 1-2-2021
PP PEC_Holders 1-2-2021 Методы и приборы оценки прочности дорожных одежд
Методы и приборы оценки прочности дорожных одежд Визитная карточка
Визитная карточка Подготовка к итоговой аттестации по русскому языку в 9, 10, 11 классах. Изобразительно-выразительные средства языка
Подготовка к итоговой аттестации по русскому языку в 9, 10, 11 классах. Изобразительно-выразительные средства языка Электронное пособие по теоретическим разделам информатики
Электронное пособие по теоретическим разделам информатики Муниципальная целевая программа Развитие сети внутрипоселковых дорог в Мартыновском сельском поселении на 2014-2016 годы
Муниципальная целевая программа Развитие сети внутрипоселковых дорог в Мартыновском сельском поселении на 2014-2016 годы презентация на тему конфликты в коллективах.причины и способы их разрешения
презентация на тему конфликты в коллективах.причины и способы их разрешения Гетьманські столиці України
Гетьманські столиці України Духовна культура Полінезійців
Духовна культура Полінезійців Международное движение рабочей силы
Международное движение рабочей силы Непроволочный резистор объемного типа, варистор
Непроволочный резистор объемного типа, варистор Технико-экономические параметры вагонов
Технико-экономические параметры вагонов