Содержание
- 2. Положение металлов в периодической системе 1. Определите местоположение металлов в периодической системе 2. Назовите самые распространённые
- 3. В Fr At I-III группа (кроме Н и В) IV-VIII группа ( в конце группы) Побочные
- 4. Строение атома Ме Внешний слой от 1 до 3 е Rа Ме R а неМе Исключение
- 5. Окислительно-восстановительные свойства А)Ме - ne Ме (окисление) восстановитель 0 +n Б) Возможные степени окисления МЕ Низшая
- 6. В) Изменение восстановительных свойств металлов в периодической системе уменьшаются в периоде увеличиваются
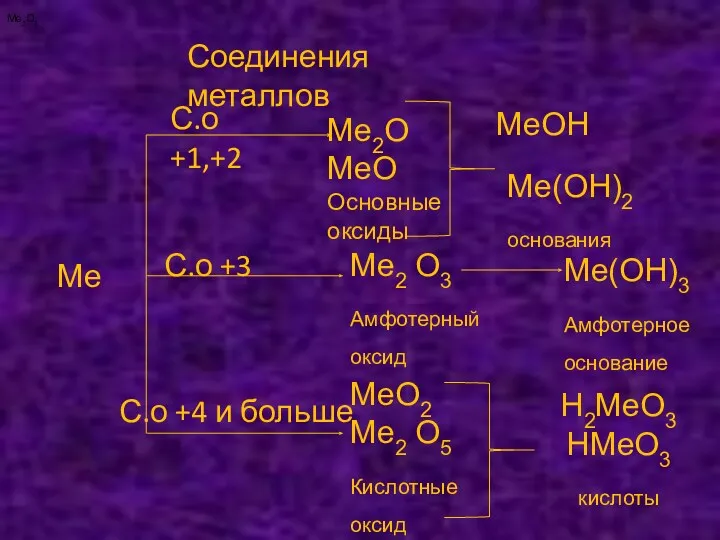
- 7. Соединения металлов Ме С.о +1,+2 С.о +3 С.о +4 и больше Ме2О МеО Основные оксиды МеОН
- 8. Летучие водородные соединения не образуют, но с водородом образуют твёрдые вещества гидриды МеН IА группа МеН2
- 9. Нахождение в природе Активные Ме – только в виде соединений NaCl, Ca3(PO4)2 Менее активные Ме –
- 10. Характеристика простых веществ -металлов 1.Строение молекулы А)Молекулы Ме - одноатомны Металлическая связь Металлическая кристаллическая решётка Твёрдые
- 11. Б) Изменение физических свойств в периодической таблице В периоде Твёрдость, температура плавления и кипения – уменьшаются(
- 12. Самый лёгкий металл P˂5 г/см3 Li p=0,53 г/см3 Самый тяжёлый металл Р ˃ 5 г/см3 Os
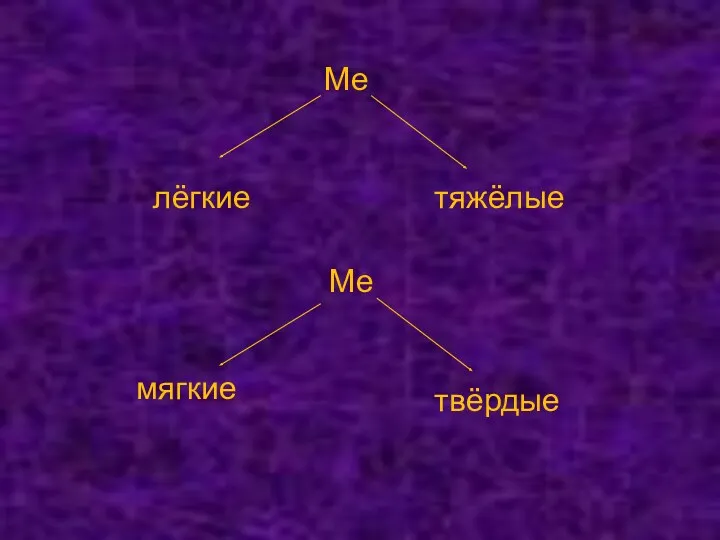
- 13. Ме лёгкие тяжёлые Ме мягкие твёрдые
- 14. Ме легкоплавкие Тугоплавкие t пл˃1000 0С Hg t пл= -38,9 0С W t пл= 33900С
- 15. Химические свойства металлов Ме вос- стано- витель НеМе О2 Н2О Оксид Ме Оксид неМе кислота соль
- 17. Скачать презентацию












 Организация работы и содержание железнодорожных переездов
Организация работы и содержание железнодорожных переездов Оймяконский улус (район)
Оймяконский улус (район) Общие сведения о строительных машинах
Общие сведения о строительных машинах Творческие работы учеников.
Творческие работы учеников. Семиотика урологических заболеваений
Семиотика урологических заболеваений Антарктида
Антарктида Изготовление объемной аппликации Букет маме
Изготовление объемной аппликации Букет маме Современная геополитика
Современная геополитика Каша-матушка наша!
Каша-матушка наша! Александр II: начало правления. Крестьянская реформа 1861 г
Александр II: начало правления. Крестьянская реформа 1861 г Итоговая лекция по дисциплине История и философия науки
Итоговая лекция по дисциплине История и философия науки Учим дорожные знаки (продолжение)
Учим дорожные знаки (продолжение) Как празднуют новый год в Германии и Франции-1
Как празднуют новый год в Германии и Франции-1 Миграции. Размещение населения.
Миграции. Размещение населения. Дробление и типы дробилок. Щёковые дробилки
Дробление и типы дробилок. Щёковые дробилки Информационно – рекомендательный обзор новой краеведческой литературы
Информационно – рекомендательный обзор новой краеведческой литературы Компания LG Group
Компания LG Group Тест
Тест Презентация: Урок-безопасности Чужой
Презентация: Урок-безопасности Чужой Токарно винторезный станок
Токарно винторезный станок презентация Осенины
презентация Осенины Субкультура скинхэды
Субкультура скинхэды Проект Зимние забавы
Проект Зимние забавы Лекция для родителей о ФГОС НОО
Лекция для родителей о ФГОС НОО Экономическая целесообразность покупки новых компьютеров и улучшения старых для курсов 3D моделирования
Экономическая целесообразность покупки новых компьютеров и улучшения старых для курсов 3D моделирования Политическое развитие СССР 1945-1953
Политическое развитие СССР 1945-1953 Усиление многопустотных плит перекрытий
Усиление многопустотных плит перекрытий Христианская апологетика и библейская стратегия благовестия
Христианская апологетика и библейская стратегия благовестия