Содержание
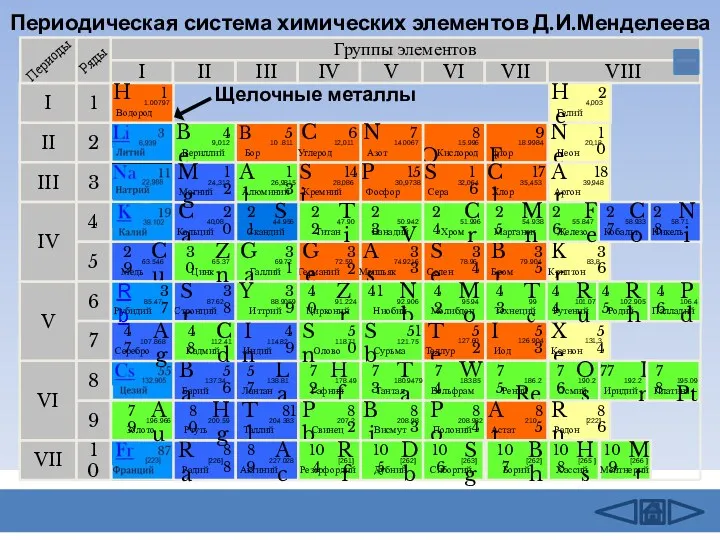
- 2. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 3. Общая характеристика элементов I группы главной подгруппы
- 4. А.Арфведсон, изучая минерал Петалит в 1817 году, открыл элемент литий в форме соединения в минерале петалит.
- 5. Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В
- 6. Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви, производивший электролиз твердого, слегка
- 7. При спектроскопическом анализе минерала лепидолит (фторсиликат лития и алюминия) и обнаружились две новые красные линии в
- 8. Этот элемент был предсказан Д.И.Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г.
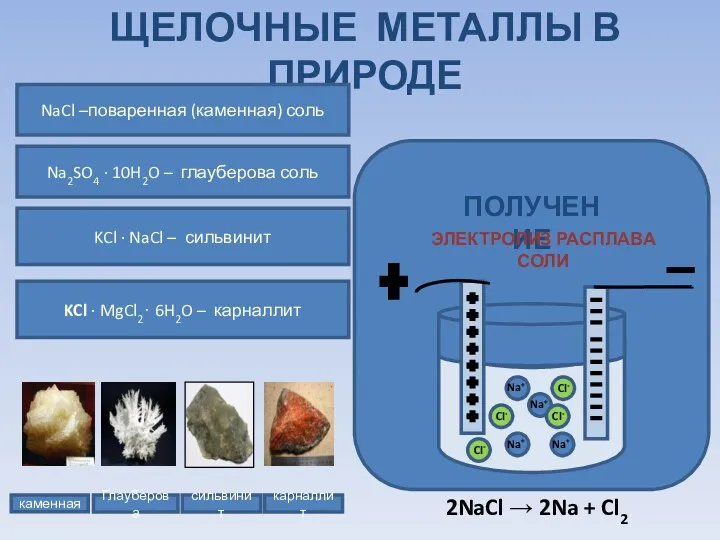
- 9. ЩЕЛОЧНЫЕ МЕТАЛЛЫ В ПРИРОДЕ каменная Глауберова сильвинит карналлит NaCl –поваренная (каменная) соль Na2SO4 ∙ 10H2O –
- 10. ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Вещества серебристо-белого цвета, кроме цезия (золотисто-желтый)Электропроводны и теплопроводны, легкоплавкие,
- 11. Химические свойства 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 4Li
- 12. Качественное определение щелочных металлов Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в
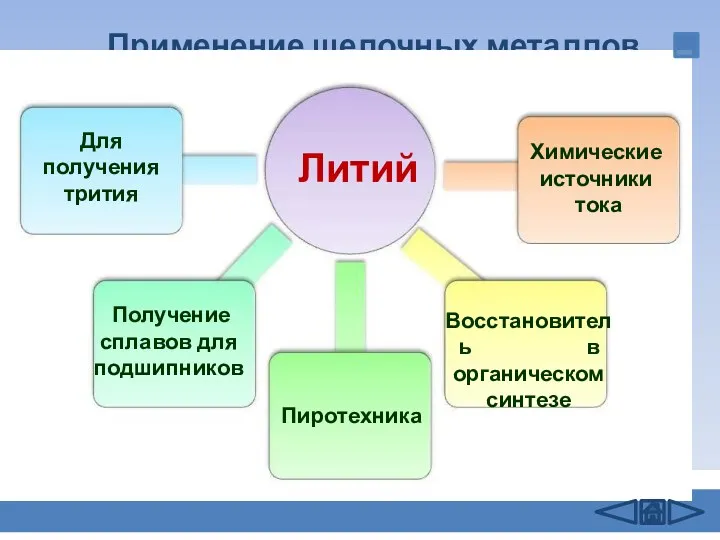
- 13. Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические
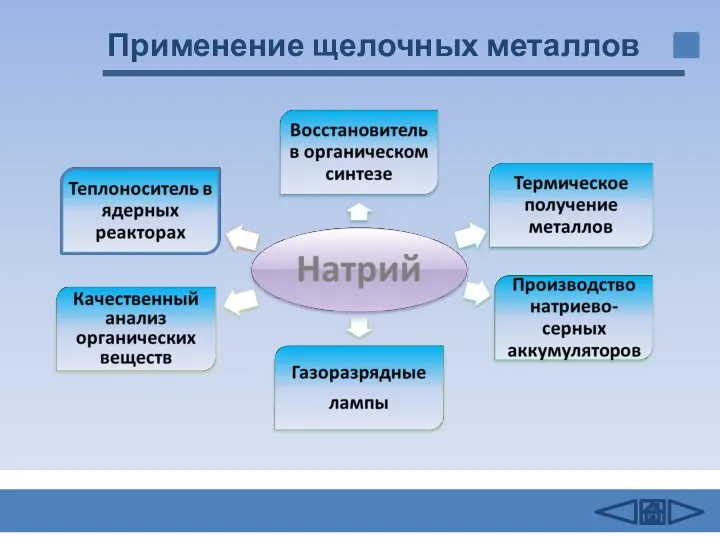
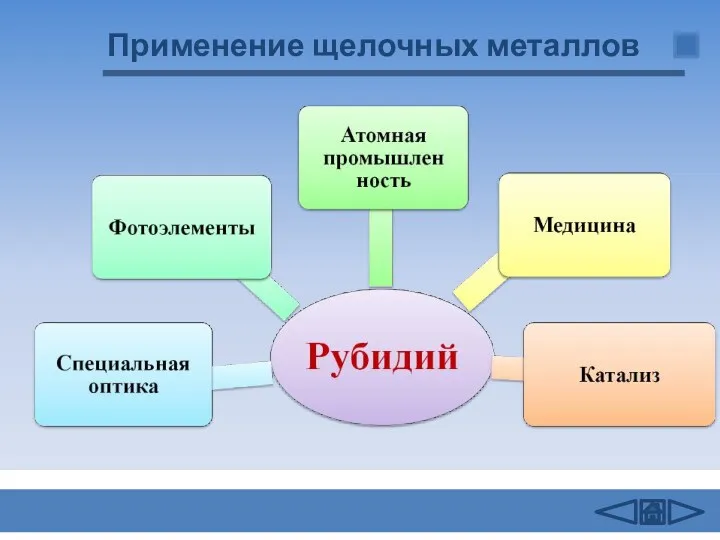
- 14. Применение щелочных металлов
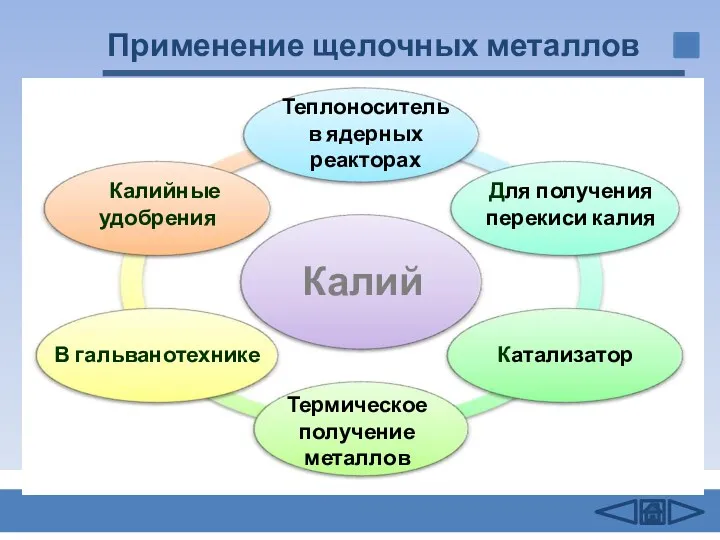
- 15. Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Для получения перекиси калия Катализатор Термическое получение металлов
- 16. Применение щелочных металлов
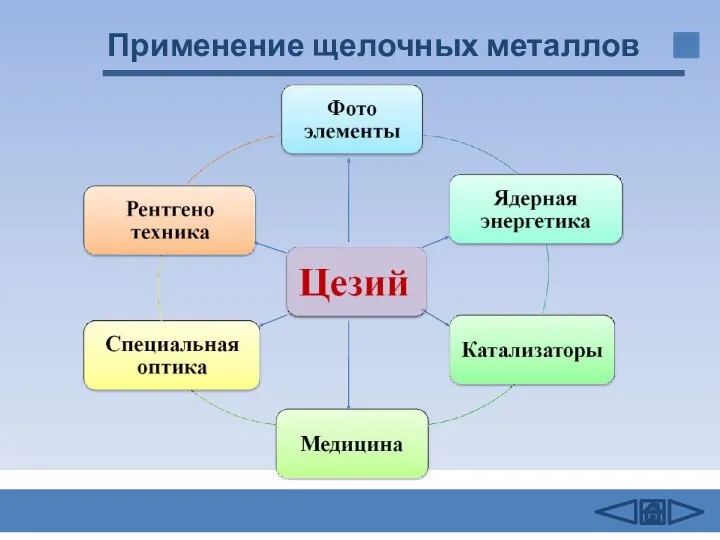
- 17. Применение щелочных металлов
- 18. Проверь себя: Выберите неверные суждения о щелочных металлах: 1. Число электронов на внешнем энергетическом уровне щелочных
- 19. § 14 (до соединений), упр.3,4 ДОМАШНЕЕ ЗАДАНИЕ
- 21. Скачать презентацию











 Төл создіц тыныс белгілері
Төл создіц тыныс белгілері Презентация на тему Чей голос?
Презентация на тему Чей голос? Diplom
Diplom Проектирование локальной вычислительной сети с доступом в сеть интернет
Проектирование локальной вычислительной сети с доступом в сеть интернет ВКР: Разработка системы управления технологическим процессом ректификации изобутанизобутиленовой фракции
ВКР: Разработка системы управления технологическим процессом ректификации изобутанизобутиленовой фракции Эксплуатация, обслуживание и ремонт общего имущества 5 этажного, 68-квартирного жилого дома в условиях г. Глазова
Эксплуатация, обслуживание и ремонт общего имущества 5 этажного, 68-квартирного жилого дома в условиях г. Глазова Алгоритм поиска погибших неизвестных воинов с использованием информационных сайтов
Алгоритм поиска погибших неизвестных воинов с использованием информационных сайтов Габдулла Кариев
Габдулла Кариев Снятие психоэмоционального напряжения у детей старшего дошкольного возраста.
Снятие психоэмоционального напряжения у детей старшего дошкольного возраста. Организация работы холодного цеха на предпприятии общественного питания
Организация работы холодного цеха на предпприятии общественного питания Концепция структуры и содержания образования по физической культуре в школе
Концепция структуры и содержания образования по физической культуре в школе Ведущие причины смерти и их профилактика с помощью ЗОЖ
Ведущие причины смерти и их профилактика с помощью ЗОЖ Звезды в жизни человека
Звезды в жизни человека Физиология и патология фетоплацентарной системы
Физиология и патология фетоплацентарной системы Лэпбук и его значение в работе с детьми дошкольного возраста
Лэпбук и его значение в работе с детьми дошкольного возраста Условия предоставления займа Антикризисная поддержка
Условия предоставления займа Антикризисная поддержка Работа социального педагога по профилактике ПАВ в условиях общеобразовательной школы
Работа социального педагога по профилактике ПАВ в условиях общеобразовательной школы Разработка технологического процесса капитального ремонта коробки подач токарноревольверного станка модели 1341
Разработка технологического процесса капитального ремонта коробки подач токарноревольверного станка модели 1341 Интеллектуальный турнир. Ломоносовские игры
Интеллектуальный турнир. Ломоносовские игры Толпа. Действия в случае давки
Толпа. Действия в случае давки eng (1)
eng (1) Конструирование оптико-электронных приборов
Конструирование оптико-электронных приборов Социальные иституты
Социальные иституты Синдром дефицита внимания и гиперактивность
Синдром дефицита внимания и гиперактивность Оценка воздействия на окружающую среду при расширении/строительстве канализационной сети в городе Каракол
Оценка воздействия на окружающую среду при расширении/строительстве канализационной сети в городе Каракол Буквы о, а на конце наречий с приставками из, до,с, за, на, в. 7 класс
Буквы о, а на конце наречий с приставками из, до,с, за, на, в. 7 класс Женские образы в произведениях изобразительного искусства России
Женские образы в произведениях изобразительного искусства России Фото на память
Фото на память