Общая и неорганическая химия. Лекция 20. Особенности химии серы. Водородные и кислородные соединения презентация
Содержание
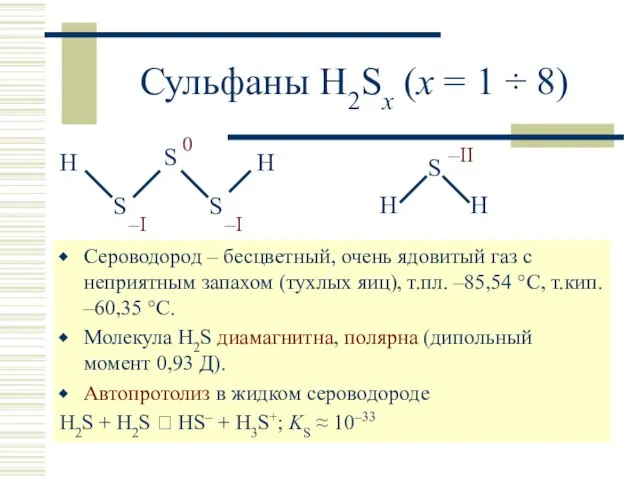
- 2. Сульфаны H2Sx (x = 1 ÷ 8) Сероводород – бесцветный, очень ядовитый газ с неприятным запахом
- 3. Водный раствор H2S (0,1 моль/л) H2S + H2O ⮀ HS– + H3O+; KK1 = 1,05 ·
- 4. Сульфиды Растворимые в воде (катионы щелочных, щёлочноземельных элементов, аммония): Na2S = 2Na+ + S2–; S2– +
- 5. Малорастворимые сульфиды
- 6. Расчет концентрации сульфид-иона в растворе H2S (0,1 моль/л) 1. H2S + H2O ⮀ HS– + H3O+
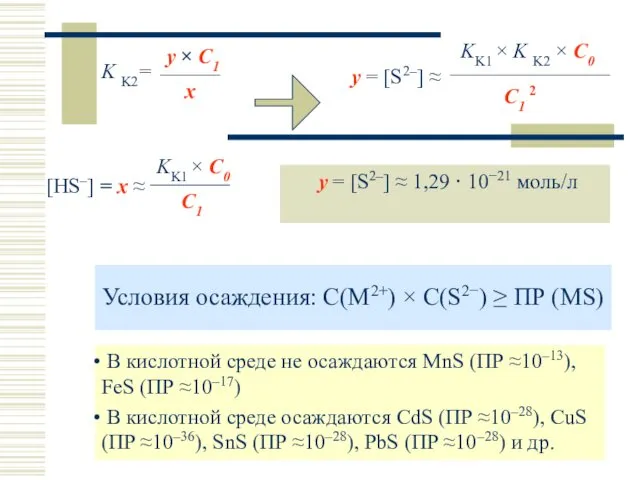
- 7. Найдем [S2–] в р-ре: H2S (0,1 моль/л) + HCl (1 моль/л) 1. H2S + H2O ⮀
- 8. Условия осаждения: С(М2+) × С(S2−) ≥ ПР (MS) y = [S2–] ≈ 1,29 · 10−21 моль/л
- 9. Восстановительные свойства H2S –2e− = S + 2H+ ; ϕ° = +0,14 В (рН HS− +
- 10. Получение В промышленности: H2 + S ⮀ H2S В лаборатории: FeS + 2HCl= FeCl2 + H2S↑
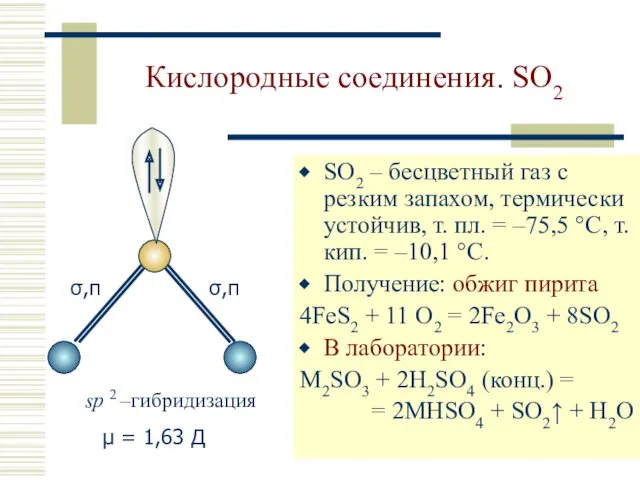
- 11. Кислородные соединения. SO2 SO2 – бесцветный газ с резким запахом, термически устойчив, т. пл. = –75,5
- 12. В водном растворе: SO2 + nH2O ⮀ SO2 · nH2O (n = 1 ÷ 7) SO2
- 13. Окислительно-восстановительные свойства SO2 + 2H2S = 3S + 2H2O SO2 + 2H2O + 4e– = S
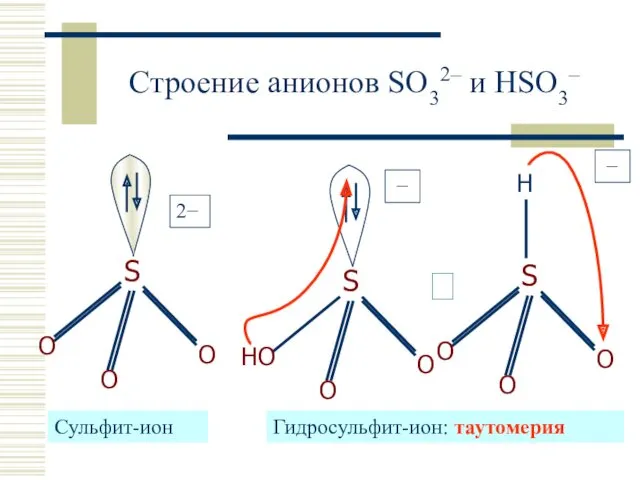
- 14. Строение анионов SO32– и HSO3– ⮀ Cульфит-ион Гидросульфит-ион: таутомерия 2− − −
- 15. Триоксид серы (SO3)x полиморфные модификации α, β и γ (т. пл. 16,8 °С, 32,0 °С и
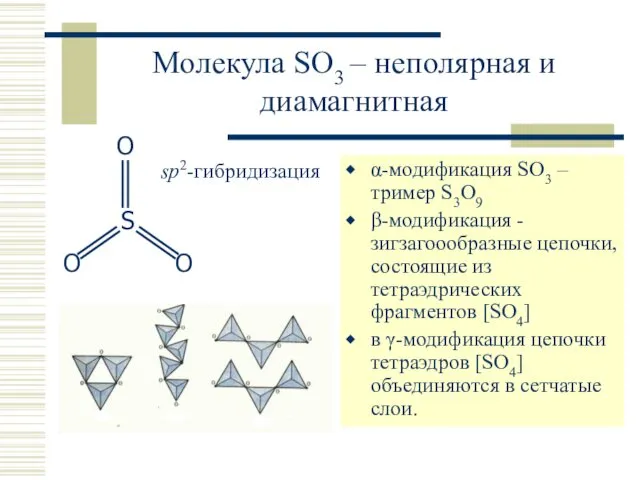
- 16. Молекула SO3 – неполярная и диамагнитная α-модификация SO3 – тример S3O9 β-модификация - зигзагоообразные цепочки, состоящие
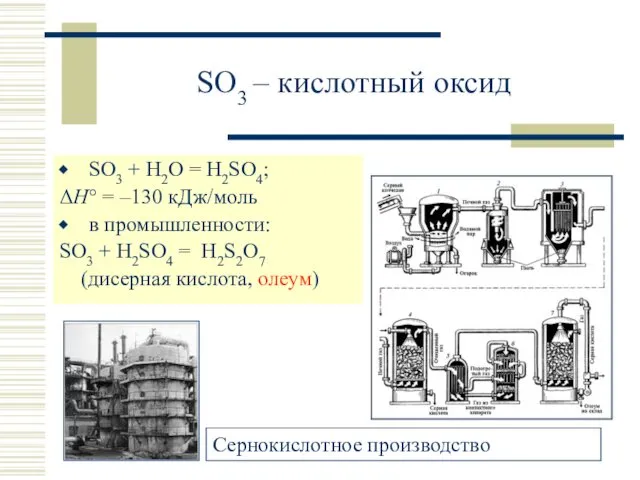
- 17. SO3 – кислотный оксид SO3 + H2O = H2SO4; ΔH° = –130 кДж/моль в промышленности: SO3
- 18. Серная кислота H2SO4 H2SO4 – бесцветная вязкая жидкость, плотность 1,84 г/см3, т. пл. 10,4 °С. Причина
- 19. H2SO4 в водной среде в разбавленном водном растворе H2SO4 – сильная двухосновная кислота: H2SO4 + 2H2O
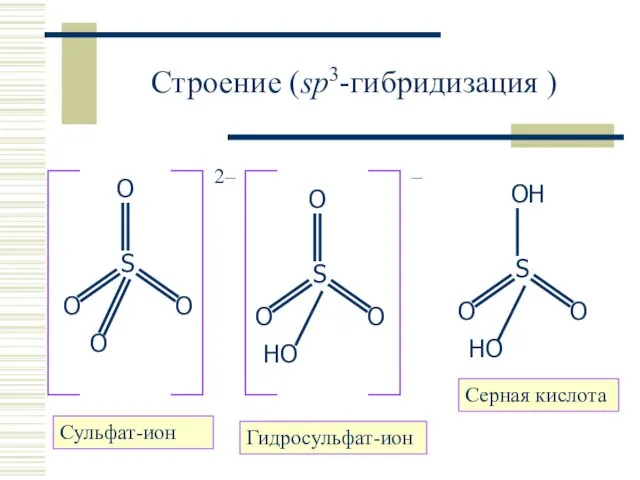
- 20. Строение (sp3-гибридизация ) Cульфат-ион Серная кислота Гидросульфат-ион
- 21. Шёниты M2IMII(SO4)2·6H2O (MI – Na, K… , MII – Mg, Zn, Co…) Купоросы MSO4·5(7)H2O (M –
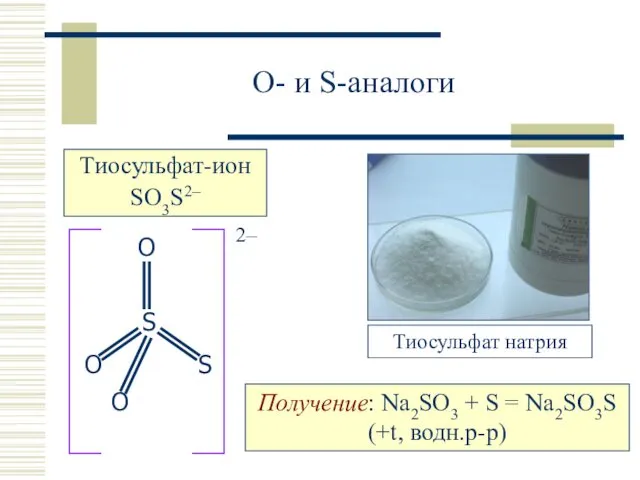
- 22. O- и S-аналоги Получение: Na2SO3 + S = Na2SO3S (+t, водн.р-р)
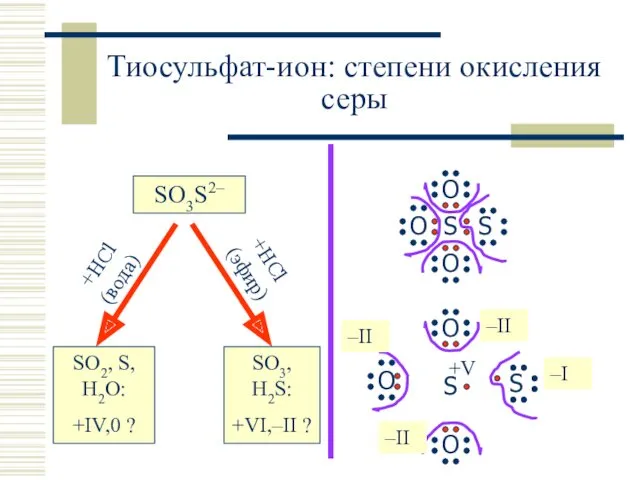
- 23. +HCl (вода) +HCl (эфир) Тиосульфат-ион: степени окисления серы SO3S2– SO2, S, H2O: +IV,0 ? SO3, H2S:
- 24. Химические свойства Na2SO3S + 2HCl = 2NaCl + H2O + SO2↑ + S↓ SO3S2− + H2O
- 25. Применение в аналитической химии: иодометрия Cu + 4HNO3 = = Cu(NO3)2 + 2NO2↑ + H2O 2Cu(NO3)2
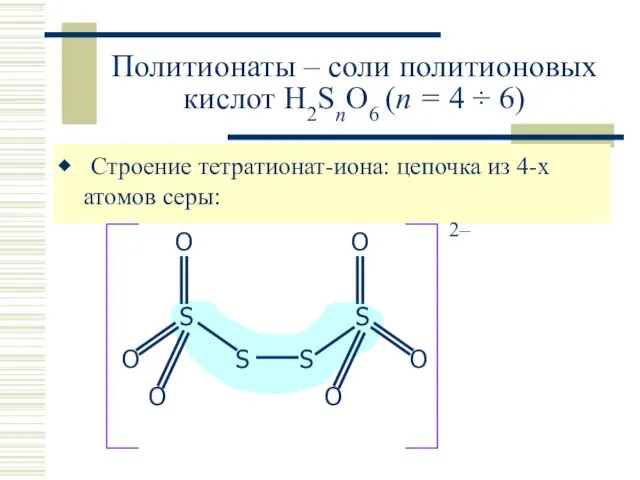
- 26. Политионаты – соли политионовых кислот H2SnO6 (n = 4 ÷ 6) Строение тетратионат-иона: цепочка из 4-х
- 28. Скачать презентацию




![Найдем [S2–] в р-ре: H2S (0,1 моль/л) + HCl (1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/87013/slide-6.jpg)










 (3)
(3) Прграмма летней площадки Город Мастеров
Прграмма летней площадки Город Мастеров Рождественский сувенир
Рождественский сувенир Аккумуляторы будущего
Аккумуляторы будущего РОСТ. Областной конкурс молодежных инновационных команд. Россия – ответственность – стратегия – технологии
РОСТ. Областной конкурс молодежных инновационных команд. Россия – ответственность – стратегия – технологии Коротко про мене
Коротко про мене Детям спички не игрушка
Детям спички не игрушка День знаний в 1 классе.
День знаний в 1 классе. практические работы
практические работы Силы трения. Трение в природе и технике
Силы трения. Трение в природе и технике Коксохимический завод в Темиртау
Коксохимический завод в Темиртау презентация калейдоскоп цветов
презентация калейдоскоп цветов Опробование месторождений полезных ископаемых
Опробование месторождений полезных ископаемых Педагогические технологии гуманистической педагогики: ролевые и деловые игры
Педагогические технологии гуманистической педагогики: ролевые и деловые игры Состав Вооруженных Сил Российской Федерации. Занятие 1
Состав Вооруженных Сил Российской Федерации. Занятие 1 Египет. Заселение территории Египта
Египет. Заселение территории Египта Деревянные конструкции
Деревянные конструкции Галогены
Галогены Зимние забавы
Зимние забавы Государственная программа развития Калининградской области Развитие транспортных систем до 2022 года
Государственная программа развития Калининградской области Развитие транспортных систем до 2022 года Холодильник
Холодильник Стихи на уроках - 5
Стихи на уроках - 5 Родительское собрание Курить – здоровью вредить.
Родительское собрание Курить – здоровью вредить. Хиросима и Нагасаки: экологические последствия
Хиросима и Нагасаки: экологические последствия Микеланджело Буонарроти, художник
Микеланджело Буонарроти, художник Поколение ЭВМ. История возникновения электронно-вычислительных машин
Поколение ЭВМ. История возникновения электронно-вычислительных машин Организация боевого дежурства в радиотехническом подразделении
Организация боевого дежурства в радиотехническом подразделении Шаблоны Сердечки
Шаблоны Сердечки