Содержание
- 2. ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА Выполним задание « Найди родственников» Из перечня формул составьте генетический ряд.(вопросы…) Ca(OH)2, CI2,
- 3. Общий вывод: Признаки которые характеризуют генетический ряд: Вещества разных классов; Разные вещества образованные одним химическим элементом,
- 4. Вспомним … 1.Валентность. 2.Степень окисления. 3.Восстановитель. 4.Окислитель. 5.Типы химических реакций.
- 5. Окислительно –восстановительные Реакции Выполнила: Бригаденко Надежда Александровна - учитель химии.
- 6. Цель урока: 1.Сформировать понятие об окислительно-восстановительных реакциях. 2.Научиться уравнивать записи ОВР методом электронного баланса.
- 7. Пример: 2Cu0 + O2 =2 Cu2+O2- 2H+CL- + Zn0 = Zn2+CL2- + H20 Реакции, в резултате
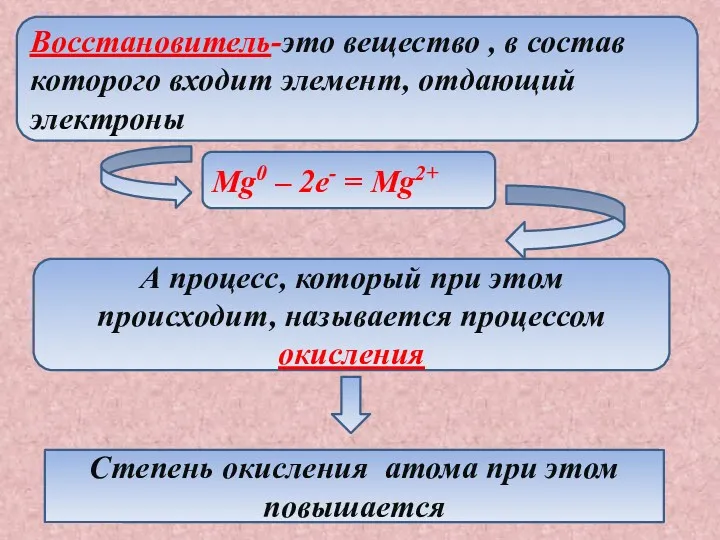
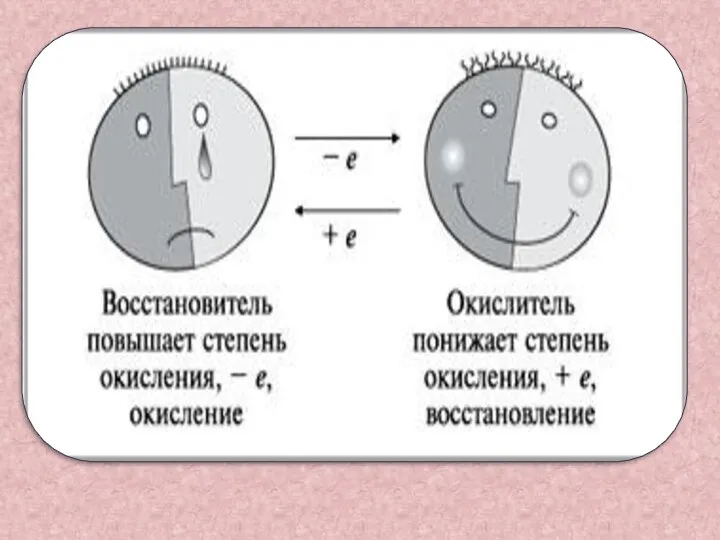
- 8. Восстановитель-это вещество , в состав которого входит элемент, отдающий электроны Mg0 – 2e- = Mg2+ А
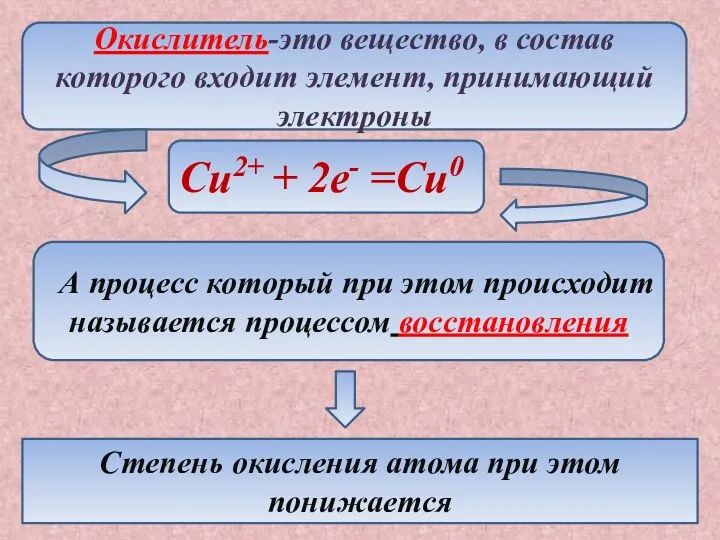
- 9. Окислитель-это вещество, в состав которого входит элемент, принимающий электроны Cu2+ + 2e- =Cu0 А процесс который
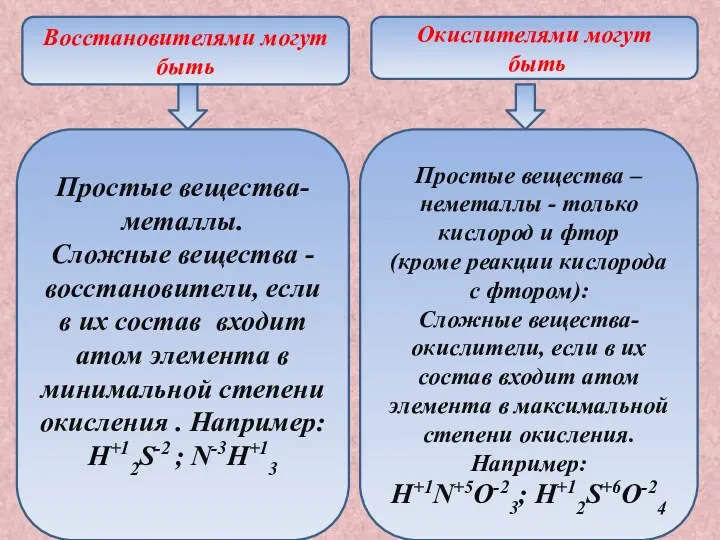
- 11. Восстановителями могут быть Окислителями могут быть Простые вещества-металлы. Сложные вещества - восстановители, если в их состав
- 12. Различают: минимальную (низшую) степень окисления S-2 2e- 8e- 8e- промежуточную степень окисления S0 2e- 8e- 6e-
- 13. Закрепление… Итог….
- 14. Д/З п.43 до стр.232 Стр.235№1,3.
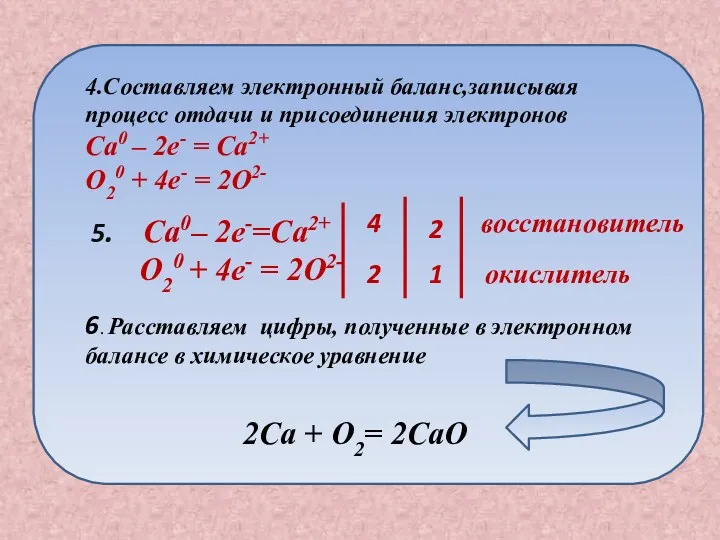
- 15. План составления окислительно -восстановительной реакции Записываем схему химической реакции Ca + O2 2. Расставляем степени окисления
- 16. 5. Ca0– 2e-=Ca2+ O20 + 4e- = 2O2- 4 2 2 1 восстановитель окислитель 6. Расставляем
- 17. Используя метод электронного баланса, допишите схемы и составьте уравнения, расставив коэффициенты Mg + O2 HCL +
- 19. Скачать презентацию











 Педагогические технологии на основе личностно-ориентированного подхода
Педагогические технологии на основе личностно-ориентированного подхода Конструкторское бюро 13.04-19.04
Конструкторское бюро 13.04-19.04 Неоплатонизм
Неоплатонизм Определение запаса насаждения
Определение запаса насаждения Дефекты сварных швов
Дефекты сварных швов Организация исследовательской деятельности учащихся на уроках математики.
Организация исследовательской деятельности учащихся на уроках математики. Повышение интереса к профессии сварщик
Повышение интереса к профессии сварщик Полевой отчёт ООО Нива
Полевой отчёт ООО Нива Презентация к семинару ИКТ на уроках английского языка 1 часть
Презентация к семинару ИКТ на уроках английского языка 1 часть Этапы развития жизни на земле
Этапы развития жизни на земле Борисова К. Н. 41-АН
Борисова К. Н. 41-АН Сущность и роль коммуникаций в системе управления
Сущность и роль коммуникаций в системе управления Меню на 02.06.15 по столовой ООО ЧАША. Завтрак
Меню на 02.06.15 по столовой ООО ЧАША. Завтрак Электрические станции и подстанции. Введение. Основные понятия, термины и определения
Электрические станции и подстанции. Введение. Основные понятия, термины и определения Медико-социальное сопровождение сирот
Медико-социальное сопровождение сирот Районный семинар школьных библиотекарей
Районный семинар школьных библиотекарей Термические повреждения, ожоги, отморожения, электротравма
Термические повреждения, ожоги, отморожения, электротравма Выдающиеся женщины-художницы
Выдающиеся женщины-художницы Игры для развития мелкой моторики своими руками.
Игры для развития мелкой моторики своими руками. Православные праздники на Руси
Православные праздники на Руси Демографическая ситуация в современной России
Демографическая ситуация в современной России Презентация Обучение дошкольников правилам дорожного движения
Презентация Обучение дошкольников правилам дорожного движения Моя улица
Моя улица Ремонт КДЦ
Ремонт КДЦ Использование нетрадиционной техники изобразительной деятельности в работе с детьми дошкольного возраста
Использование нетрадиционной техники изобразительной деятельности в работе с детьми дошкольного возраста Иероним Босх (около 1460-1516гг.)
Иероним Босх (около 1460-1516гг.) Презентация Художественное выпиливание
Презентация Художественное выпиливание Подготовка к ОГЭ по алгебре (базовая часть)
Подготовка к ОГЭ по алгебре (базовая часть)