Слайд 2

План лекции
1. Основные понятия и определения.
2.Метод электронного баланса.
3. Классификация
ОВР.
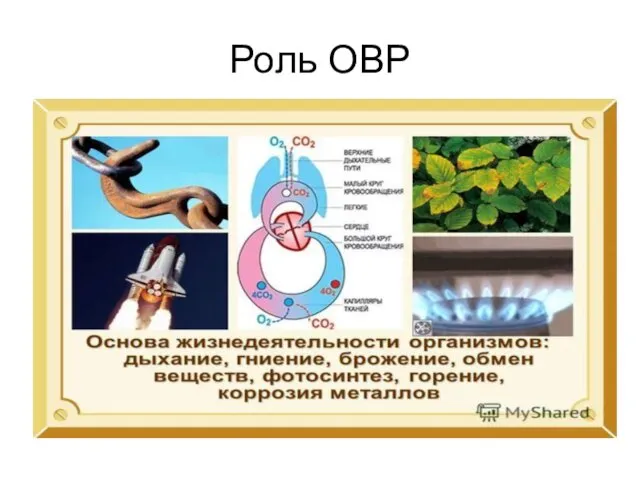
4. Значение ОВР.
5. Электролиз как окислительно-восстановительный процесс; практическое использование.
Слайд 3

Чем заняты эти парни?
Кто из них натрий, кто хлор?
Слайд 4
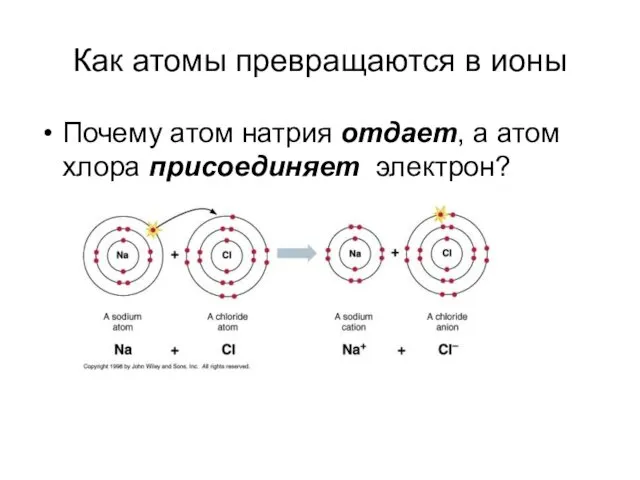
Как атомы превращаются в ионы
Почему атом натрия отдает, а атом хлора
присоединяет электрон?
Слайд 5
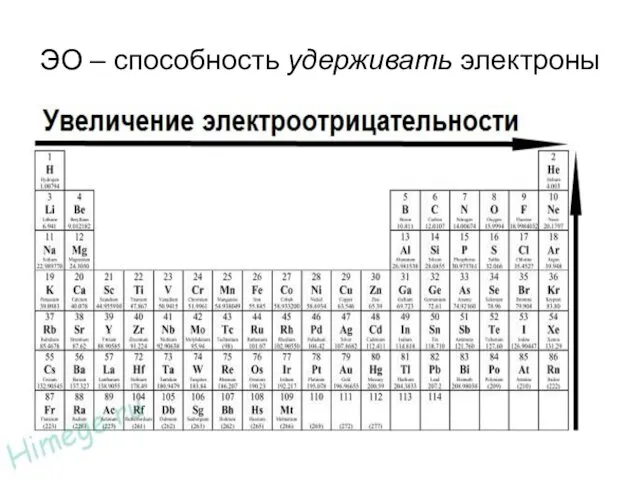
ЭО – способность удерживать электроны
Слайд 6
Слайд 7

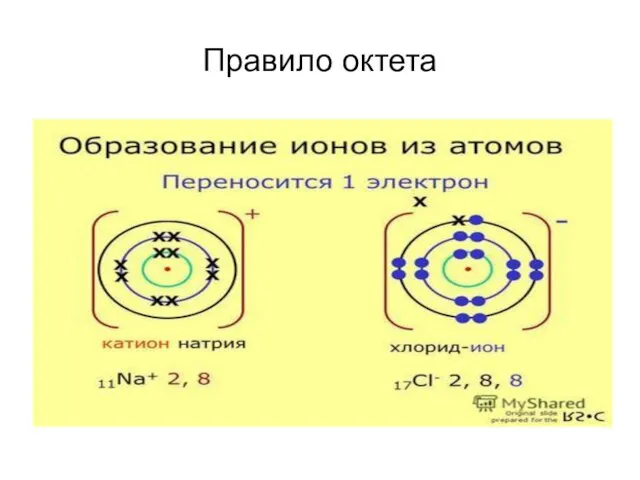
Степень окисления (СО)
Это условный заряд на атоме элемента в соединении, рассчитанный
исходя из предположения, что все общие электронные пары перешли от менее электроотрицательного (ЭО) к более ЭО атому.
Не путать СО с валентностью !!!
Слайд 8

Важное определение
ОВР - это такие химические реакции, в которых происходит передача
ЭЛЕКТРОНОВ от одних частиц (атомов, молекул, ионов) к другим, в результате чего изменяется степень окисления атомов, входящих в состав этих частиц.
Слайд 9
Слайд 10

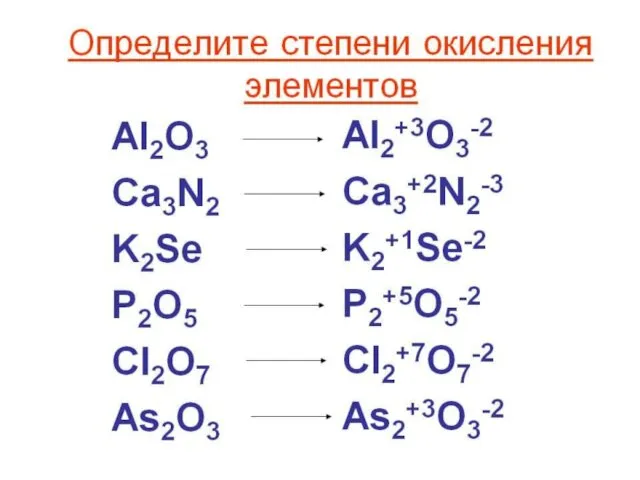
Правила расчета степени окисления (СО)
1.Сумма СО всех атомов в частице равна
заряду этой частицы.
2. Более электроотрицательным атомам соответствует более низкая СО.
3. Щелочные металлы, фтор, бор, алюминий ИМЕЮТ ПОСТОЯННЫЕ степени окисления
4. Максимальная СО равна номеру группы В пс ( ЕСТЬ исключения).
Слайд 11

Слайд 12

Слайд 13

Переменные СО атома азота
Слайд 14

СО железа в его соединениях
Слайд 15
Слайд 16

Слайд 17

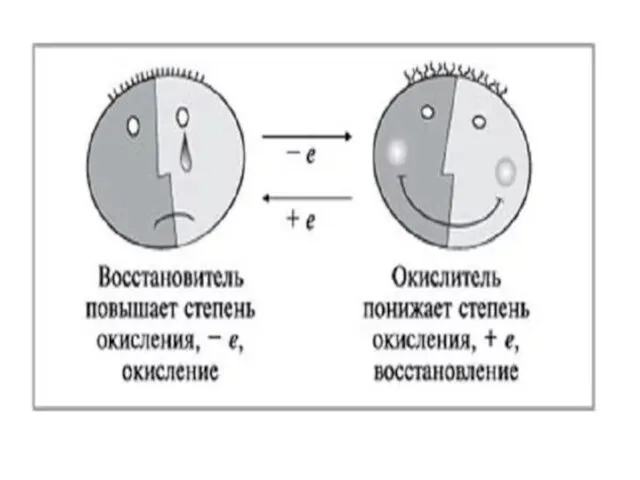
Основные понятия
Окислитель (Ox) – частица, которая в ходе ОВР приобретает электроны.
Восстановитель (Red) – частица, которая в ходе ОВР отдает электроны. Восстановление – процесс, в ходе которого окислитель приобретает электроны и переходит в сопряженную восстановленную форму. Окисление – процесс, в ходе которого восстановитель отдает электроны и переходит в сопряженную окисленную форму.
Слайд 18

Может ли реакция протекать справа налево?
Слайд 19

Направление ОВР
Термодинамические процессы, в том числе ОВР, протекают самопроизвольно только в
случае уменьшения свободной энергии Гиббса (G), т е. когда из более сильных окислителя и восстановителя образуются менее сильные окислитель и восстановитель, соответственно.
Слайд 20

Слайд 21

Стандартный окислительно-восстановительный потенциал (E0)
ЭДС = E0 ок.формы - E0 восст .формы,
КоличественнОЙ характеристикОЙ ОВ СПОСОБНОСТИ веществ и ЯВЛЯЕТСЯ E0 -cтандартный окислительно-восстановительный потенциал. Чем больше положительное значение E0 (В), тем более сильным является окислитель.
Слайд 22
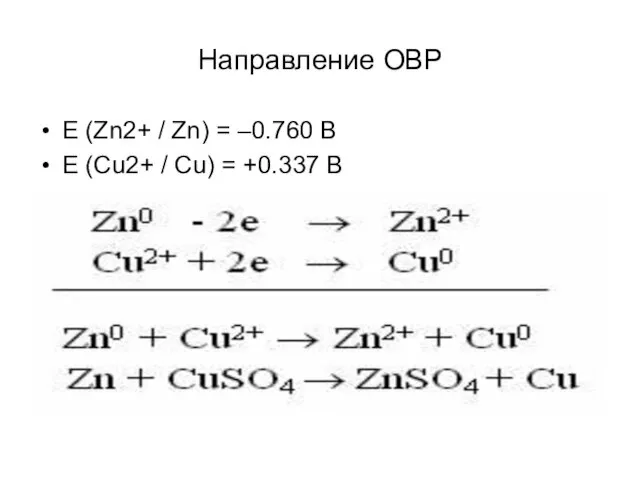
Направление ОВР
E (Zn2+ / Zn) = –0.760 В
E (Cu2+ /
Cu) = +0.337 В
Слайд 23

Слайд 24
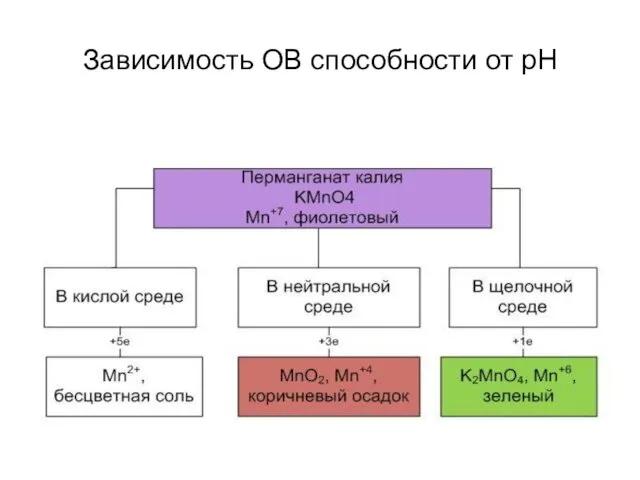
Зависимость ОВ способности от рН
Слайд 25

Слайд 26

Метод электронного баланса
Слайд 27

Метод электронного баланса
Слайд 28
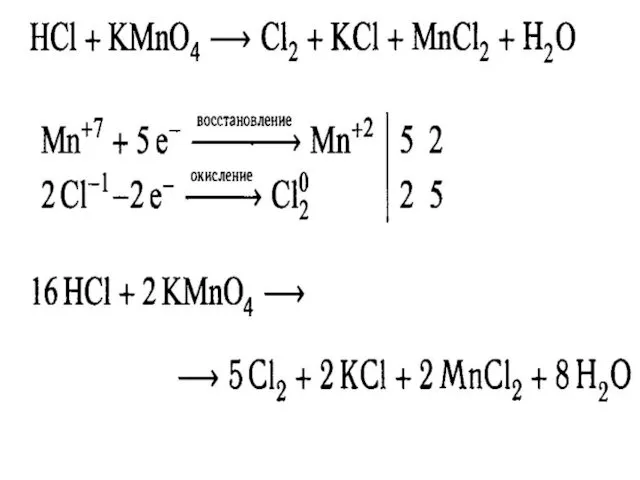
Метод электронного баланса
Слайд 29

Слайд 30

Слайд 31
Слайд 32

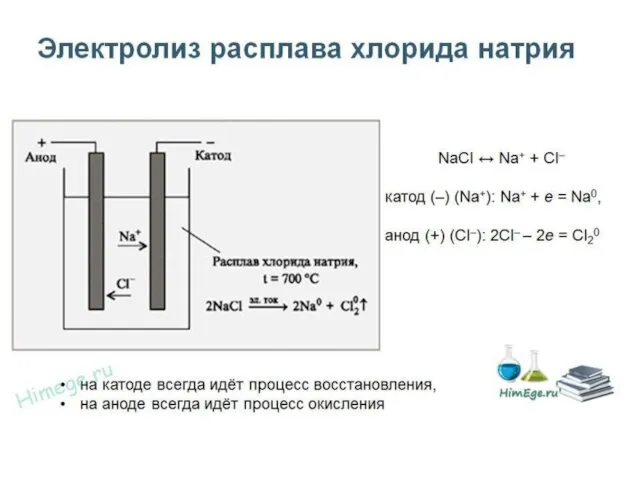
Электролиз
Окислительно-восстановительный процесс разложения электролитов под действием постоянного электрического тока.
Слайд 33

Сущность электролиза!
Состоит в том, что электрический ток может быть сильным окислителем
и восстановителем. За счет его энергии могут протекать те реакции, которые самопроизвольно протекать не могут, а следовательно, могут быть получены те вещества, которые другими способами получить затруднительно.
Слайд 34
Слайд 35

Электролиз растворов
При электролизе растворов наряду с процессами восстановления катионов и окисления
анионов вещества на электродах, могут восстанавливаться или окисляться и молекулы воды.
Слайд 36

Слайд 37

Слайд 38

Слайд 39

Слайд 40

Слайд 41

Слайд 42

Электролиз водного раствора сульфата натрия
Слайд 43

Важный вывод
В водном растворе
на катоде никогда не восстанавливаются катионы
типичных восстановителей, вместо них
восстанавливается вода.
на аноде никогда не окисляются анионы оксокислот, вместо них окисляется вода.
Слайд 44

Слайд 45

Слайд 46

Слайд 47

Слайд 48

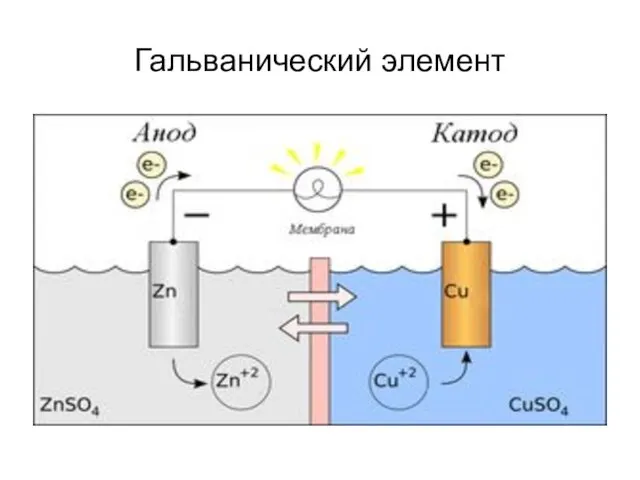
Гальвани́ческий элеме́нт
Это химический источник электрического тока, основанный на ОВР между двумя
металлами в растворах электролитов. Назван в честь Луиджи Гальвани. в гальванических элементах происходит переход химической энергии в электрическую.
Слайд 49


























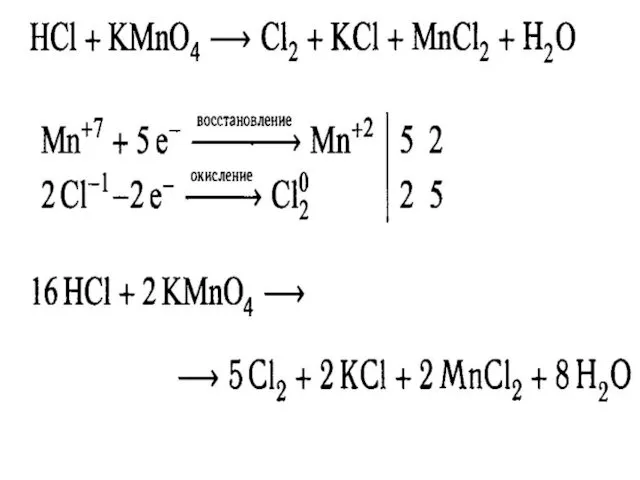





















 Вышивание. Изделие своими руками. Проект
Вышивание. Изделие своими руками. Проект Оборона Курска
Оборона Курска Презентация к уроку. Ветер
Презентация к уроку. Ветер Стандартные исследования образцов горных пород (продолжение)
Стандартные исследования образцов горных пород (продолжение) Физика в боевых искусствах
Физика в боевых искусствах Мой опыт использования разнообразных форм работы с родителями
Мой опыт использования разнообразных форм работы с родителями Внутреннее строение рыб
Внутреннее строение рыб Презентация по химии для 10 класса по теме Сложные эфиры
Презентация по химии для 10 класса по теме Сложные эфиры Жизненная форма
Жизненная форма Классный час Волшебники добра
Классный час Волшебники добра Урок Мой край Югра
Урок Мой край Югра Презентация - Продвижение информационной составляющей официального сайта МБОУСОШ № 14 г. Тулы в соответствии с постановлением правительства № 582 и концепцией муниципального проекта Открытая школа
Презентация - Продвижение информационной составляющей официального сайта МБОУСОШ № 14 г. Тулы в соответствии с постановлением правительства № 582 и концепцией муниципального проекта Открытая школа Возможности макетов для детей среднего возраста, Харюкова ОА
Возможности макетов для детей среднего возраста, Харюкова ОА ПРОБЛЕМЫ СОЦИАЛИЗАЦИИ ПОДРОСТКОВ (Практические исследования)
ПРОБЛЕМЫ СОЦИАЛИЗАЦИИ ПОДРОСТКОВ (Практические исследования) The Present Tenses
The Present Tenses Нравственное воспитание младших школьников на уроке Окружающий мир
Нравственное воспитание младших школьников на уроке Окружающий мир Как ходить в музей
Как ходить в музей Эванычу. Поздравляю тебя от всей души с днём варенья
Эванычу. Поздравляю тебя от всей души с днём варенья Неорганические кислоты
Неорганические кислоты презентация Снежная сказка
презентация Снежная сказка Что такое светская этика.
Что такое светская этика. Прикладное програмное обеспечение компьютера. Командная строка и командные файлы
Прикладное програмное обеспечение компьютера. Командная строка и командные файлы Красители: натуральные или искусственные?
Красители: натуральные или искусственные? Выявление особенностей связного повествовательного высказывания у старших дошкольников с интеллектуальными нарушениями
Выявление особенностей связного повествовательного высказывания у старших дошкольников с интеллектуальными нарушениями Театральный кружок Малышок
Театральный кружок Малышок Презентация волшебные узоры
Презентация волшебные узоры Классный час о здоровье.1-2 класс.
Классный час о здоровье.1-2 класс. Телепередача В мире перелетных птиц
Телепередача В мире перелетных птиц