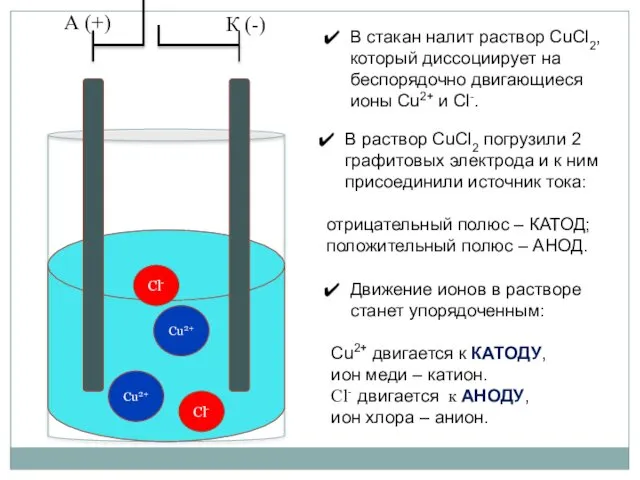
Сравнение величин электродных потенциалов приводит к выводу:
Катодный процесс:
1. В растворах солей
металлов, стоящих в ЭХН левее Al, происходит катодное восстановление воды.
2. В растворах солей металлов, стоящих в ЭХН правее водорода, происходит восстановление металла.
3. В растворах солей металлов, находящихся между Al и Н2, возможно одновременное восстановление металла и молекул воды
Анодный процесс:
1. В растворах, содержащих анионы кислородсодержащих кислот, происходит анодное окисление воды.
2. В растворах, содержащих анионы бескислородных кислот (кроме F-), происходит анодное окисление аниона.







 Алтайскому краю - 77 лет
Алтайскому краю - 77 лет Методическая разработка развлечения ко дню защитника отечества
Методическая разработка развлечения ко дню защитника отечества Роль ников в Интернете
Роль ников в Интернете Государство и экономика
Государство и экономика Презентация Районы Республики Марий Эл.
Презентация Районы Республики Марий Эл. Психология как наука
Психология как наука Презентация мастер-класса Бумагопластика
Презентация мастер-класса Бумагопластика Проект модернизации поста текущего ремонта, агрегатов для СТО
Проект модернизации поста текущего ремонта, агрегатов для СТО Мотивация деятельности
Мотивация деятельности Текстовый редактор Microsoft Word
Текстовый редактор Microsoft Word Основные направления деятельности предприятия Лозахолдинг Липецкая область
Основные направления деятельности предприятия Лозахолдинг Липецкая область История философии. Основные этапы формирования западноевропейской мысли: от античности до 20го века
История философии. Основные этапы формирования западноевропейской мысли: от античности до 20го века все профессии нужны, все профессии важны
все профессии нужны, все профессии важны Презентация Ранний возраст
Презентация Ранний возраст Технические средства телекоммуникационных технологий
Технические средства телекоммуникационных технологий Мультимедийный тест. 9 класс
Мультимедийный тест. 9 класс Понятие формы. Многообразие форм окружающего мира
Понятие формы. Многообразие форм окружающего мира Классификация морских сооружений по функциональному принципу
Классификация морских сооружений по функциональному принципу ПрезентацияНарушение прав человека
ПрезентацияНарушение прав человека Авиационный транспорт
Авиационный транспорт ВКР, образец
ВКР, образец Презентация проекта Формирование и развитие социально значимых ценностей, гражданственности и патриотизма у детей дошкольного возраста.
Презентация проекта Формирование и развитие социально значимых ценностей, гражданственности и патриотизма у детей дошкольного возраста. Психокоррекция как форма практической помощи человеку
Психокоррекция как форма практической помощи человеку Синдром дефицита внимания с гиперактивностью
Синдром дефицита внимания с гиперактивностью Страны Латинской Америки
Страны Латинской Америки Welt der zahlen
Welt der zahlen Basics of Beekeeping
Basics of Beekeeping Кадровое делопроизводство
Кадровое делопроизводство