Слайд 2
Слайд 3
Слайд 4
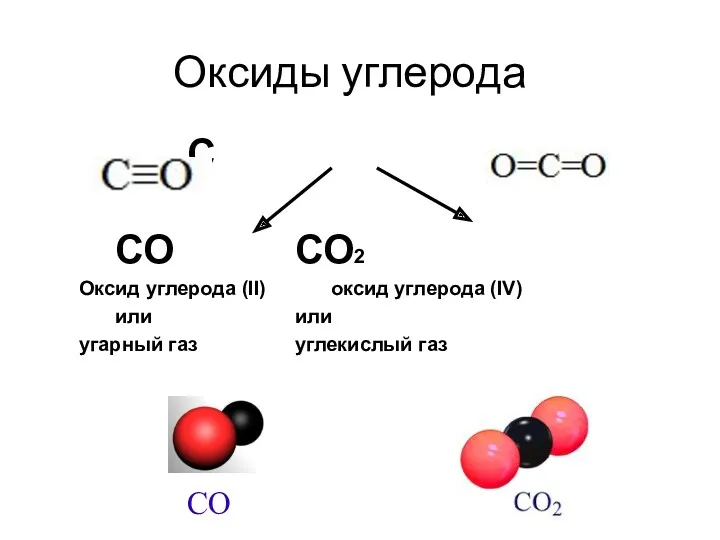
Оксиды углерода
С
СО СО2
Оксид углерода (II) оксид углерода (IV)
или или
угарный газ углекислый газ
СО
Слайд 5

Оксид углерода (II)
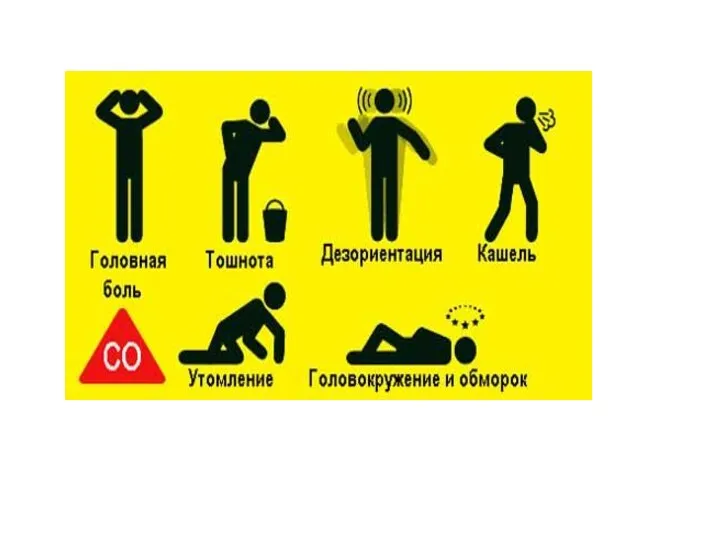
Угарный газ — бесцветный, не имеющий запаха, плохо растворимый
в воде ядовитый газ, относится к несолеобразующим оксидам.
Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода (II) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов:
CuO + CO = Cu + CO2
На воздухе угарный газ горит:
2CO + O2 = 2CO2
Слайд 6

Слайд 7
Слайд 8

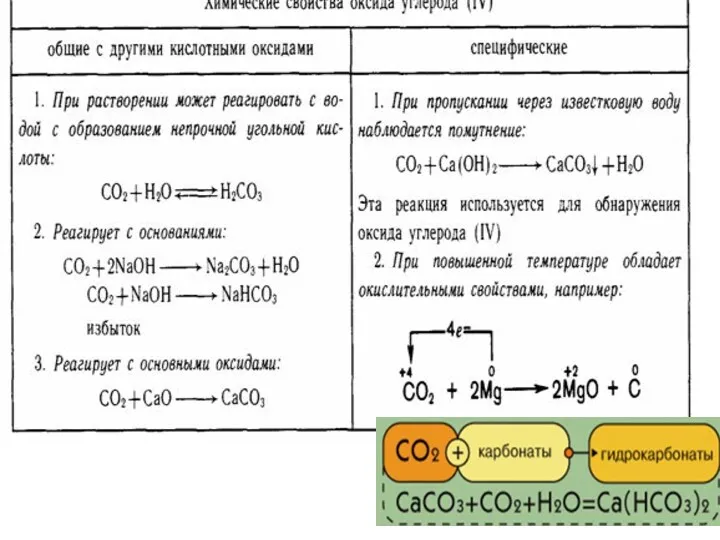
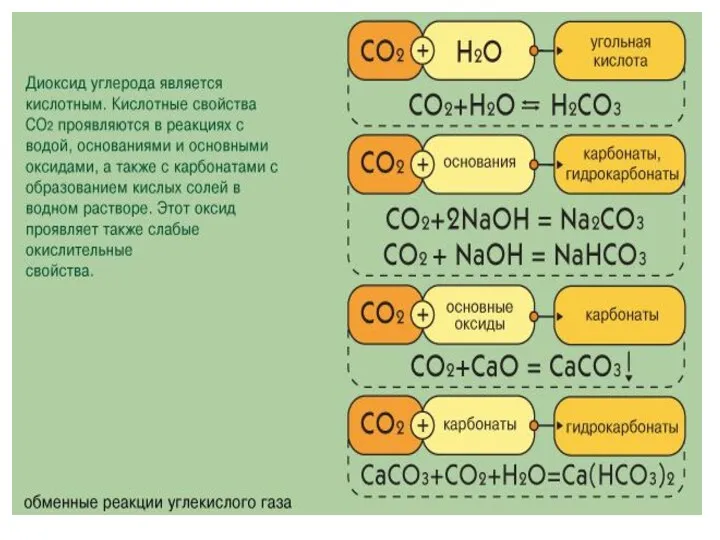
Оксид углерода (IV)
Углекислый газ
– газ без цвета и запаха. Это
кислотный оксид, ему соответствует двухосновная угольная кислота.
Растворение оксида углерода (IV) — обратимый процесс:
H2O + CO2 ↔ H2CO3
Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде:
CO2 + 2Mg = 2MgO + С
Слайд 9

Слайд 10
Слайд 11
Слайд 12

Получение оксида углерода (IV)
В лаборатории оксид углерода (IV) получают взаимодействием
карбоната кальция (мел, мрамор) с соляной кислотой в аппаратах Киппа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
В промышленности этот оксид получают сжиганием угля и при обжиге известняка:
C + O2 = CO2
CaCO3 = CaO + CO2











 Презентация Путешествие в страну Здоровья
Презентация Путешествие в страну Здоровья Физиология внешней нервной деятельности. Торможение условных рефлексов. Типы ВНД
Физиология внешней нервной деятельности. Торможение условных рефлексов. Типы ВНД Инженерно-геологические изыскания
Инженерно-геологические изыскания Программа СОЦИАЛЬНО - ПЕДАГОГИЧЕСКАЯ ПОДДЕРЖКА УЧАЩИХСЯ В ОБРАЗОВАТЕЛЬНОМ УЧРЕЖДЕНИИ
Программа СОЦИАЛЬНО - ПЕДАГОГИЧЕСКАЯ ПОДДЕРЖКА УЧАЩИХСЯ В ОБРАЗОВАТЕЛЬНОМ УЧРЕЖДЕНИИ Инструкция по работе с дилерскими подсайтами
Инструкция по работе с дилерскими подсайтами Презентация От благодарных читателей
Презентация От благодарных читателей Кредитная и банковская системы
Кредитная и банковская системы Роль иероглифов в китайской культуре
Роль иероглифов в китайской культуре Вымирание горбатых китов
Вымирание горбатых китов Отчет по неделе игры и игрушки (подготовительная группа)
Отчет по неделе игры и игрушки (подготовительная группа) Отчет о работе НОУ 2014/15
Отчет о работе НОУ 2014/15 Аналитический отчёт
Аналитический отчёт Презентации учащихся 4 класса о космосе к дням науки
Презентации учащихся 4 класса о космосе к дням науки Электродвигатели постоянного тока
Электродвигатели постоянного тока Конституционное право
Конституционное право Теория фотоэффекта
Теория фотоэффекта Надзор прокурора за исполнением судебных решений о применении принудительных мер медицинского характера
Надзор прокурора за исполнением судебных решений о применении принудительных мер медицинского характера Презентация1
Презентация1 Презентация Принципы построения предметно-развивающей среды
Презентация Принципы построения предметно-развивающей среды 8 Марта
8 Марта Представления
Представления Презентация к уроку по теме Алкены
Презентация к уроку по теме Алкены Курорт на черном море город Анапа
Курорт на черном море город Анапа Классный уголок
Классный уголок Средства физического воспитания
Средства физического воспитания Интеллектуальная игра по географии Путешествие по странам и континентам
Интеллектуальная игра по географии Путешествие по странам и континентам Все вокруг-геометрия! Мастер-класс. Элементы Пентамино
Все вокруг-геометрия! Мастер-класс. Элементы Пентамино Системный анализ. (Лекция 2)
Системный анализ. (Лекция 2)