Слайд 2Определение. Общая формула
Алкены – ациклические углеводороды, в молекулах которых между атомами углерода одна
двойная связь
Общая формула
Слайд 3Особенности строения алкенов
Sp2 – гибридизация
Свободное вращение вокруг двойной связи невозможно
Плоскостное строение
Слайд 5Изомерия, характерная для алкенов
Структурная
Изомерия углеродного скелета
Изомерия положения кратной связи
Межклассовая изомерия с циклоалканами
Слайд 6Изомерия, характерная для алкенов
Геометрическая изомерия
-цис и -транс изомерия
Слайд 7Номенклатура
В названиях используется суффикс - ЕН
Нумерация с той стороны, где ближе двойная связь
Слайд 8Физические свойства
Газы –
Жидкости –
Твердые вещества – высшие алкены
Слайд 9Физические свойства
Алкены плохо растворимы в воде, но хорошо — в органических растворителях. Этилен
и пропилен горят коптящим пламенем.
Алкены легче воды
С увеличением молекулярной массы, температура плавления и кипения увеличиваются
Слайд 10Химические свойства
Этиленовые углеводороды обладают большей химической активностью, чем предельные углеводороды. Потому что активность
зависит от строения, - связь менее прочная, чем , поэтому она легко разрывается
Слайд 11Химические свойства
Реакции присоединения
Гидрирование
Гидратация
Слайд 12Химические свойства
Галогенирование
Гидрогалогенирование
Слайд 13Правило В. В. Марковникова
Присоединение галогеноводородов и воды к несимметричным алкенам происходит по правилу Марковникова
В.В.
Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
Слайд 14Правило В. В. Марковникова
Исключения:
Если в алкене присутствует электроноакцепторный заместитель, т.е. группа, способная оттягивать
на себя электронную плотность
Присоединение в присутствии Н2О2 (эффект Хараша) или органической перекиси
Слайд 15Химические свойства
Реакция полимеризации
Слайд 16Химические свойства
Реакции окисления
Горение
Частичное окисление
Слайд 17Химические свойства
Окисление перманганатом калия в нейтральной среде (р. Вагнера)
Это качественная реакция алкенов,
розовый раствор марганцовки обесцвечивается.
Слайд 18Химические свойства
Влияние среды на характер продуктов реакций окисления
1. Окисление в кислой среде при
нагревании идёт до
а) карбоновых кислот
б) кетонов (если атом углерода при двойной связи содержит два заместителя)
Слайд 19Химические свойства
в) до углекислого газа (если двойная связь на конце молекулы, то образуется
муравьиная кислота, которая легко окисляется до CO2)
2. Окисление в нейтральной или слабощелочной среде на холоде
Слайд 20Получение алкенов
В лаборатории
Из этилового спирта (дегидратация)*
Отщепление галогенводородов из галогеноалканов*
Слайд 21Получение алкенов
Дигалогенирование дигалогеноалканов*
* Отщепление молекулы H2O и галогеноводородов происходит по правилу А. М.
Зайцева:
Отрыв атома водорода происходит от наименее гидрогенизированного атома углерода.
Слайд 22Получение алкенов
В промышленности
Крекинг алканов
Дегидрирование алканов
Слайд 23Получение алкенов
Гидрирование алканов
 An Introduction to Metabolism
An Introduction to Metabolism Праздник Новый год.
Праздник Новый год. Методическое пособие проведения оценки 2017. WorldSkills Russia
Методическое пособие проведения оценки 2017. WorldSkills Russia Анализ данных ежедневных атмосферных осадков г. Нур-Султан (Астана)
Анализ данных ежедневных атмосферных осадков г. Нур-Султан (Астана) занятие 15.02
занятие 15.02 Средства и формы обучения ИЯ. Лекция 7
Средства и формы обучения ИЯ. Лекция 7 Разработка персонального сайта с помощью сервисов по конструированию сайтов
Разработка персонального сайта с помощью сервисов по конструированию сайтов Обзор аномалий коронарных артерий: норма и патология
Обзор аномалий коронарных артерий: норма и патология Портфолио учителя изобразительного искусства
Портфолио учителя изобразительного искусства Aero Master XP
Aero Master XP Позитивное мышление
Позитивное мышление Woher kommst du
Woher kommst du изготовление букетов из конфет
изготовление букетов из конфет Тенденции моды в стрижке и укладке волос за 2016-2017 годы
Тенденции моды в стрижке и укладке волос за 2016-2017 годы Система управления охраной труда (стб 18001-2009)
Система управления охраной труда (стб 18001-2009) Педагогические советы
Педагогические советы 100 имен Аскинского района Часть 1
100 имен Аскинского района Часть 1 Творческий проект как одна из форм технологии неформального образования
Творческий проект как одна из форм технологии неформального образования Mis vacaciones de verano
Mis vacaciones de verano Презентация к уроку Атлантический океан7 класс
Презентация к уроку Атлантический океан7 класс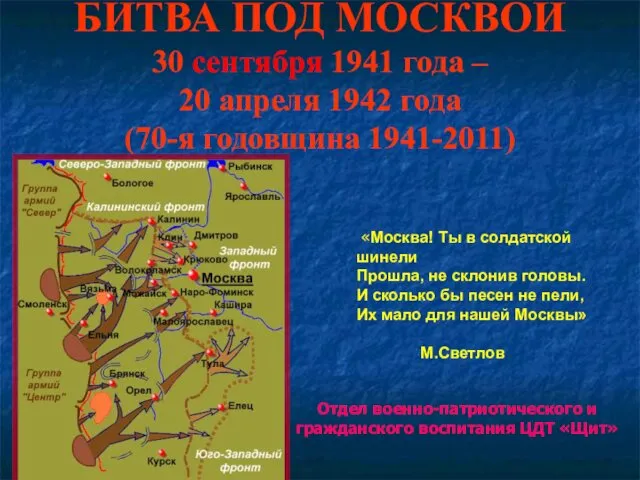 Битва под Москвой 30 сентября 1941 года – 20 апреля 1942 года
Битва под Москвой 30 сентября 1941 года – 20 апреля 1942 года Презентация История новогодней игрушки.
Презентация История новогодней игрушки. Красная книга Птицеград
Красная книга Птицеград Пост. Великопостная молитва Св. Ефрема Сирина
Пост. Великопостная молитва Св. Ефрема Сирина Have got
Have got Мастер - класс Модульное оригами
Мастер - класс Модульное оригами Инструменты для металлообработки
Инструменты для металлообработки Көлік қызметі
Көлік қызметі