Содержание
- 2. Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород,
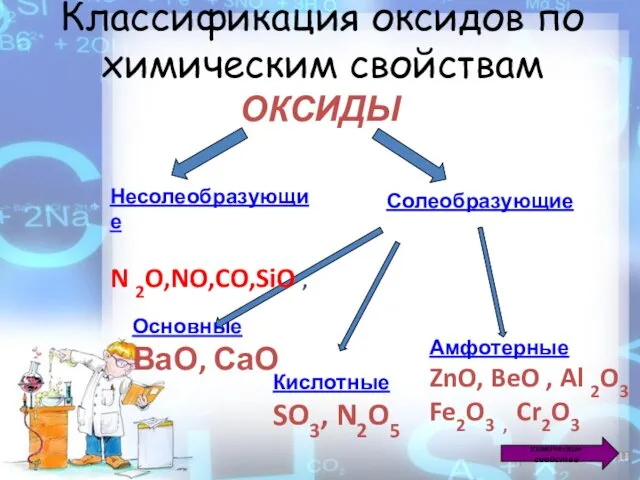
- 3. Классификация оксидов по химическим свойствам ОКСИДЫ Солеобразующие Основные ВаО, СаО Кислотные SO3, N2O5 Амфотерные ZnO, BeO
- 4. Какие элементы образуют кислотные и основные оксиды? Основные оксиды образуют металлы, которые проявляют валентность I, II,
- 5. Химические свойства оксидов 1 правило: О+О # К+К # О+К = 2 правило: При реакции двух
- 6. Химические свойства основных оксидов 1.Взаимодействие с водой- 8 шт. : Правило: при взаимодействии основных оксидов с
- 7. Химические свойства основных оксидов Обратите внимание! С водой взаимодействуют только оксиды активных металлов 8штук (лития, натрия,
- 8. Химические свойства основных оксидов 2. Взаимодействие с кислотными оксидами: Примеры: СаО + N2O5 = Ca(NO3)2 о.о.
- 9. Химические свойства основных оксидов 3. Взаимодействие с кислотами Правило: При взаимодействии основных оксидов с кислотами образуются
- 10. Химические свойства кислотных оксидов Взаимодействие с водой Правило: Все кислотные оксиды с водой образуют кислоты (кроме
- 11. Химические свойства кислотных оксидов Взаимодействие с водой Правило: Все кислотные оксиды с водой образуют кислоты, кислотный
- 12. Химические свойства кислотных оксидов 2. Взаимодействие кислотных оксидов с основными оксидами (см. выше) СО2 + Na2О
- 13. Химические свойства кислотных оксидов 3. Взаимодействие с основаниями, но только растворимыми (с щелочами) !!! Правило: образуются
- 14. Химические свойства кислотных оксидов Примеры: P2O5 +3Ba(OH)2 = Ba3(PO4)2 +3H2O К.О. основание (Р) соль
- 15. Закрепление пройденного материала
- 16. HCl
- 17. CaO MgCl2 Na2O NaOH ZnO FeCl3 BaO Ca(OH)2 Fe2O3 HCl SO3 NO Выбери только оксиды
- 18. Составьте формулы оксидов Магния Калия Фосфора (V) Хлора (VII ) Железа (II) Углерода (IV) Серы (VI)
- 19. Напишите уравнения реакций получения оксидов: Оксида кальция Оксида алюминия Оксида серы (IV) Оксида фосфора (V) Оксида
- 20. 4. Написать формулы оснований и кислот , которые соответствуют данным оксидам: SO3 , N2O5 , Al2O3
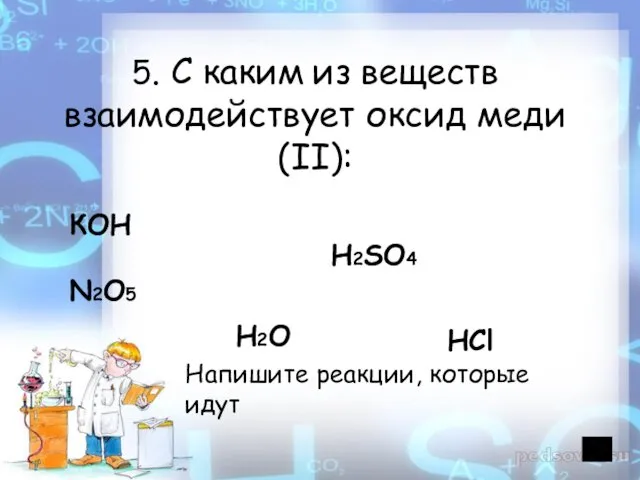
- 21. 5. С каким из веществ взаимодействует оксид меди (II): КОН H2SO4 N2O5 H2O Напишите реакции, которые
- 23. Скачать презентацию


















 Методы сведения балансов горючих ВЭР и снижения их потерь. Общие положения
Методы сведения балансов горючих ВЭР и снижения их потерь. Общие положения Создание наглядных средств обучения
Создание наглядных средств обучения ЗДОРОВЬСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ НА УРОКАХ ГЕОГРАФИИ
ЗДОРОВЬСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ НА УРОКАХ ГЕОГРАФИИ Викторина : Сохраним природу
Викторина : Сохраним природу У кс в оу Л-6 SCm Метод разделения ответственности
У кс в оу Л-6 SCm Метод разделения ответственности Нарушения мышления: расстройства ассоциативного процесса. Патология суждений и умозаключений
Нарушения мышления: расстройства ассоциативного процесса. Патология суждений и умозаключений конспект занятия Цветовая гармония в декоративных узорах
конспект занятия Цветовая гармония в декоративных узорах Презентация Мы-пешеходы
Презентация Мы-пешеходы Тренинг на применение в начальной школе средств воспитания младших школьников
Тренинг на применение в начальной школе средств воспитания младших школьников Классические теории западной геополитики
Классические теории западной геополитики Деревянные кружева.
Деревянные кружева. Рельеф
Рельеф Пороки древесины. Лекция 1
Пороки древесины. Лекция 1 Особливості вирощування саджанців фундука в умовах південно-західного Лісостепу України
Особливості вирощування саджанців фундука в умовах південно-західного Лісостепу України Бизнес, әлеуметтік-экономикалық мән және кәсіпорын
Бизнес, әлеуметтік-экономикалық мән және кәсіпорын ПОДВИГ ДЕТЕЙ ВО ВРЕМЯ ВЕЛИКОЙ ОТЕЧЕСТВЕННОЙ ВОЙНЫ
ПОДВИГ ДЕТЕЙ ВО ВРЕМЯ ВЕЛИКОЙ ОТЕЧЕСТВЕННОЙ ВОЙНЫ Профессии Кузбасса
Профессии Кузбасса журнал№2;1;3
журнал№2;1;3 Антонио Гауди-и-Корнет Архитектура как скульптура
Антонио Гауди-и-Корнет Архитектура как скульптура Сенсорные системы. Органы чувств. Понятие об анализаторах. Орган вкуса и обоняния. Кожа и ее производные
Сенсорные системы. Органы чувств. Понятие об анализаторах. Орган вкуса и обоняния. Кожа и ее производные Структурализм 1960-1990 гг
Структурализм 1960-1990 гг Железобетонные колонны
Железобетонные колонны Removing 6634 UEPP
Removing 6634 UEPP Нужна ли философия современному человеку
Нужна ли философия современному человеку Страстная седмица
Страстная седмица Конфеты
Конфеты Здравствуй, школа!
Здравствуй, школа! Asante Bamboo Bikes
Asante Bamboo Bikes