Слайд 2

История открытия.
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно
другим алхимикам, Бранд пытался отыскать эликсир жизни или философский камень, а получил светящееся вещество.
Существуют данные, что фосфор умели получать еще арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Слайд 3

Слайд 4

Название элемента.
Название «фосфор» происходит от греческих слов «фос» — свет и «феро» —
несу.
В древнегреческой мифологии имя Фосфор (или Эосфор, греч. Φώσφορος) носил страж Утренней звезды.
Слайд 5

Строение атома фосфора.
Фосфор – элемент №15 – расположен
в 3 периоде,
в V группе
Периодической системы элементов.
Схема строения атома:
Р +15 ) ) )
2 8 5
Слайд 6

Фосфор – простое вещество.
В обычных условиях фосфор – это
несколько аллотропных
модификаций:
белый, красный и черный фосфор.
Слайд 7

Белый фосфор.
Это белая прозрачная
воскообразная масса (при
охлаждении
становится хрупкой)
или прозрачные кристаллы похожие на
алмазы. Светится в темноте.
Белый фосфор химически активеное
вещество. Белый фосфор – яд!!!
(поражение костей, костного мозга,
некроз челюстей)
Слайд 8

Слайд 9

Применение белого фосфора.
Основная часть фосфора (около 90%) идет
на производство фосфорной
кислоты
Н3РО4.
Для получения соединений фосфора.
Дымообразующее и зажигательное
средство; для изготовления боеприпасов.
Слайд 10

Красный фосфор.
Это красно-коричневые
кристаллы. Загорается
в воздухе при поджигании.
Не ядовитый!
Красный фосфор используется в
металлургии, производстве
полупроводниковых материалов и ламп
накаливания, используется производстве
спичек.
Слайд 11

Горение красного фосфора.
Слайд 12

Слайд 13

Чёрный фосфор.
Это чёрные кристаллы
с металлическим
блеском, не
растворим в
воде и органических растворителях.
Хорошо проводит электрический ток.
Используется как полупроводник.
Слайд 14

Химические свойства фосфора.
Слайд 15

Нахождение фосфора в природе.
В земной коре содержится около 0,08%
фосфора. В
природе фосфор содержится
в виде соединений – минералов
(апатиты и фосфориты).
Слайд 16
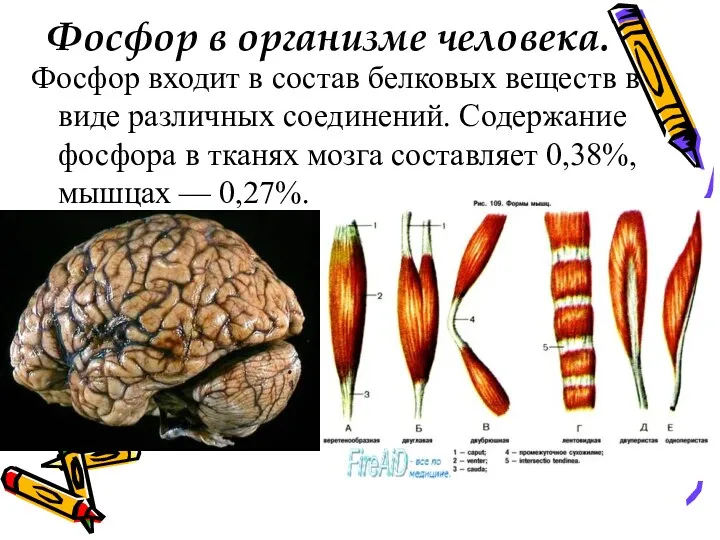
Фосфор в организме человека.
Фосфор входит в состав белковых веществ в виде
различных соединений. Содержание фосфора в тканях мозга составляет 0,38%, мышцах — 0,27%.
Слайд 17
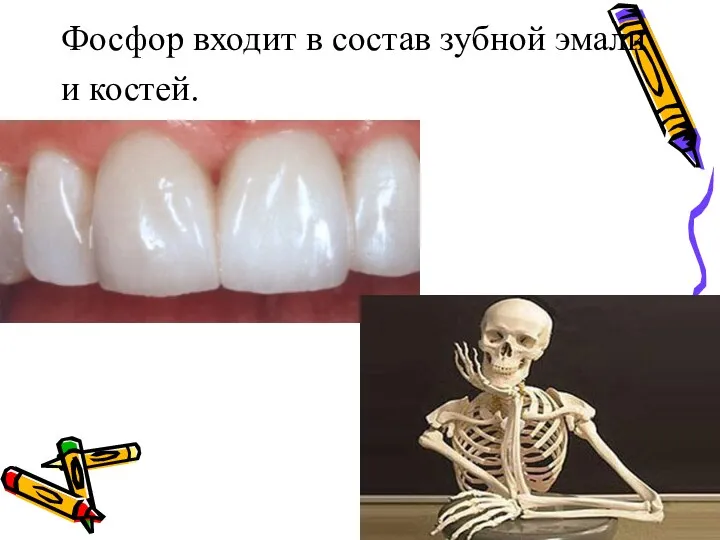
Фосфор входит в состав зубной эмали
и костей.
















 1.3.6 Эксплуатации средств защиты органов дыхания (СИЗОД)
1.3.6 Эксплуатации средств защиты органов дыхания (СИЗОД) Инна Гамазкова стихотворение Кто как кричит
Инна Гамазкова стихотворение Кто как кричит Неживая природа
Неживая природа Аускультация лёгких
Аускультация лёгких Давление насыщенных паров
Давление насыщенных паров Возникновение и основные черты мусульманского права
Возникновение и основные черты мусульманского права Виды конструкторской документации
Виды конструкторской документации Лиса -рыжая краса (Как лиса научилась звук С произносить)
Лиса -рыжая краса (Как лиса научилась звук С произносить) Здоровый образ жизни. Классный час Мы выбираем жизнь
Здоровый образ жизни. Классный час Мы выбираем жизнь Пропорциональное деление
Пропорциональное деление Microsoft Access - реляционная СУБД корпорации Microsoft
Microsoft Access - реляционная СУБД корпорации Microsoft Презентация к внеклассному занятию Учимся играя.Учимся радоваться жизни
Презентация к внеклассному занятию Учимся играя.Учимся радоваться жизни Аэрофотосьемочные работы
Аэрофотосьемочные работы Устройство Контроля Схода Подвижного Состава
Устройство Контроля Схода Подвижного Состава Дом:дети,отец,мать. Духовно-нравственное развитие младших школьников.
Дом:дети,отец,мать. Духовно-нравственное развитие младших школьников. Творческий коррекционно-развивающий проект Курочка Ряба и Колобок
Творческий коррекционно-развивающий проект Курочка Ряба и Колобок Развитие правильного звукопроизношения. Одежда
Развитие правильного звукопроизношения. Одежда Презентация Сталинградская битва
Презентация Сталинградская битва MSC. Sustainability at MSC 2022
MSC. Sustainability at MSC 2022 Правила дорожного движения
Правила дорожного движения чудеса россии
чудеса россии ТРЕБОВАНИЯ К УСЛОВИЯМ РЕАЛИЗАЦИИ ОСНОВНОЙ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ ДОШКОЛЬНОГО ОБРАЗОВАНИЯ
ТРЕБОВАНИЯ К УСЛОВИЯМ РЕАЛИЗАЦИИ ОСНОВНОЙ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ ДОШКОЛЬНОГО ОБРАЗОВАНИЯ Социология как наука
Социология как наука РЕНЕ ДЕКАРТ
РЕНЕ ДЕКАРТ Токсикологическая характеристика оксидов серы
Токсикологическая характеристика оксидов серы Блокада Ленинграда: малые памятники.
Блокада Ленинграда: малые памятники. Қытай мен Қазақстанның байланысы
Қытай мен Қазақстанның байланысы Баренцево море
Баренцево море