Содержание
- 2. «Продолжай успешно идти по дороге, на которой хорошо начал свой путь» (Из античной мудрости)
- 3. Взаимопроверка домашнего задания.
- 4. Взаимопроверка домашнего задания. Упражнение 2, с. 169. 2NaCl + H2SO4 = Na2SO4 + 2HCl (р. обмена)
- 5. Санатории Беларуси
- 6. Классная работа. Основания.
- 7. План изучения темы: Состав, названия и определение оснований. Классификация оснований. Физические свойства оснований. Химические свойства оснований.
- 8. Минута истории
- 9. Страна Оснований раздел Воспоминаний (состав, названия и определение оснований)
- 10. Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп.
- 11. Состав оснований: Назовите составные части оснований. Ме(ОН)х Валентность гидроксогруппы (ОН) – I Количество гидроксогрупп определяется валентностью
- 12. Выберите формулы оснований. Назовите их. НСl, NaOH, Na2O, Ca(OH)2, H2SO4, P2O5, Fe(OH)3, MgO, Cи(OH)2
- 13. Основания NaOH – гидроксид натрия Ca(OH)2 – гидроксид кальция Fe(OH)3 – гидроксид железа (III) Cи(OH)2 –
- 14. Страна Оснований раздел Классификаций
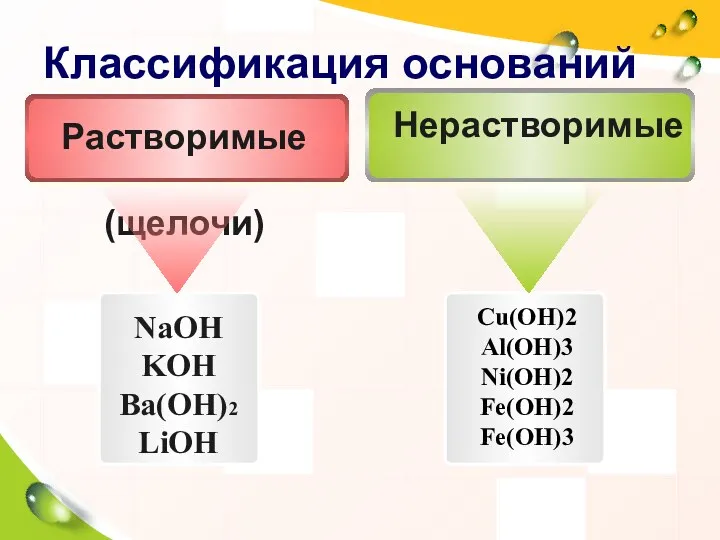
- 15. Классификация оснований NaOH KOH Ba(OH)2 LiOH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)2 Fe(OH)3 Нерастворимые Растворимые (щелочи)
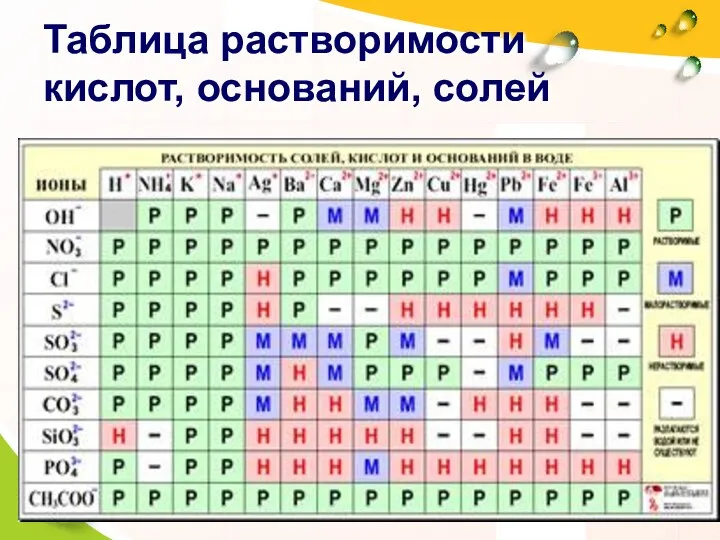
- 16. Таблица растворимости кислот, оснований, солей
- 18. По какому признаку основания разделены на группы? NaOH KOH LiOH СsOH Cu(OH)2 Ba(OH)2 Pb(OH)2 Fe(OH)2 Al(OH)3
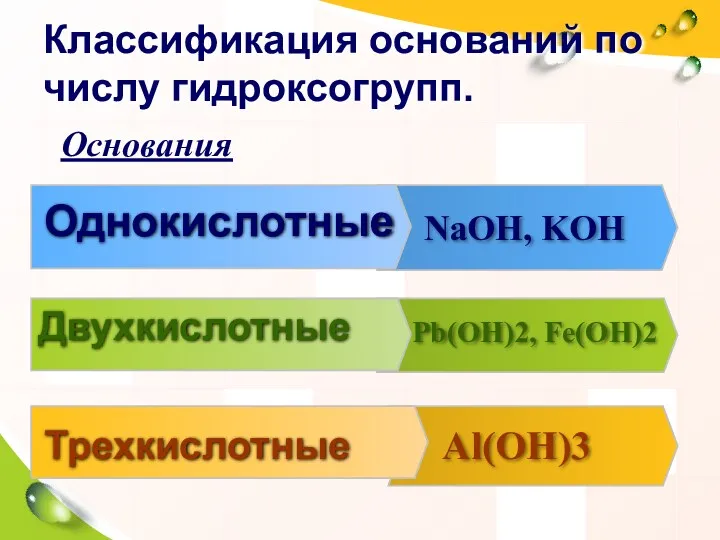
- 19. Однокислотные NaOH, KOH Двухкислотные Pb(OH)2, Fe(OH)2 Трехкислотные Al(OH)3 Классификация оснований по числу гидроксогрупп. Основания
- 20. Выполните задание
- 21. Страна Оснований раздел Физический (свойства)
- 22. Физические свойства оснований Агрегатное состояние: Все твердые вещества Цвет кислот: Белого – КОН, Голубого - Cu(OH)2
- 23. Физкультминутка
- 24. Страна Оснований раздел Химический (свойства)
- 25. Самостоятельная работа с учебником с.172 (табл. 17).
- 26. Химические свойства нерастворимых оснований. 1). Разлагаются при нагревании. 2). Взаимодействуют с кислотами (реакция нейтрализации).
- 27. Смотрим видеофрагмент
- 28. 1. Термическое разложение нерастворимых оснований: Химические свойства оснований: t t
- 29. 2. Основание + кислота: Химические свойства оснований: Реакция нейтрализации – это…
- 30. Химические свойства щелочей. 1). Изменяют окраску индикаторов. Взаимодействуют с: 2). кислотами (реакция нейтрализации), 3). кислотными оксидами,
- 31. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора щелочи
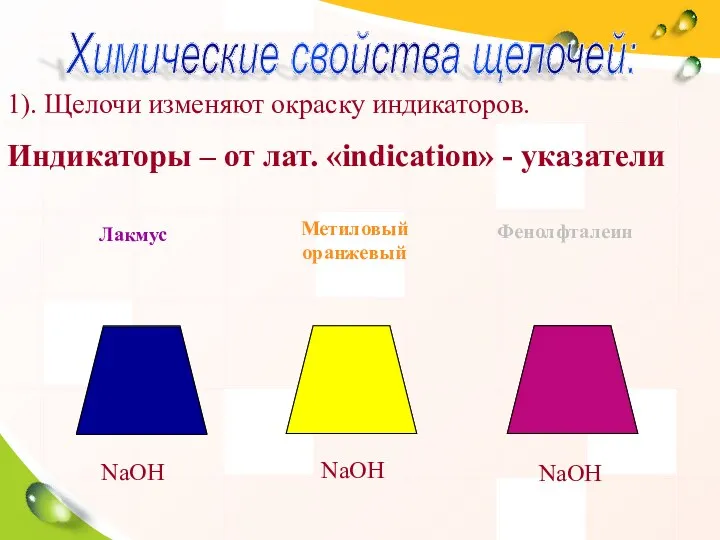
- 32. 1). Щелочи изменяют окраску индикаторов. Индикаторы – от лат. «indication» - указатели NaOH NaOH NaOH Лакмус
- 33. Щелочь + кислота : Ва(ОН)2 + 2НСl = ВаСl2 + 2Н2О хлорид бария Химические свойства щелочей:
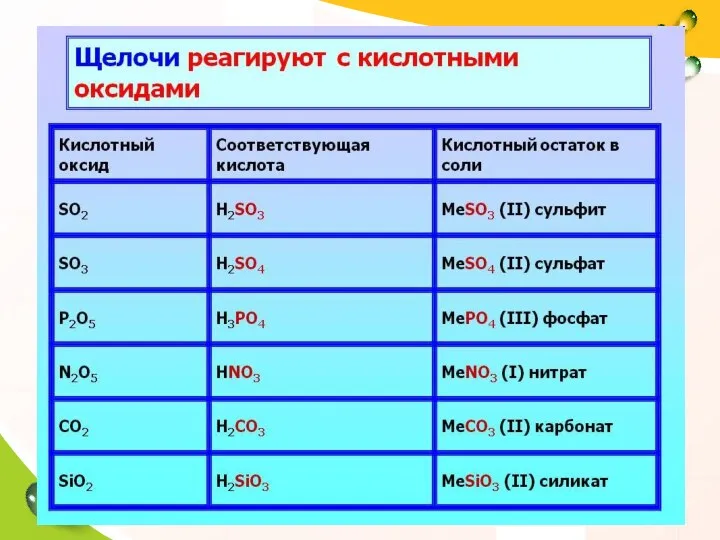
- 34. 3. Щелочь + кислотный оксид: Химические свойства щелочей: ! В ходе реакции образуется соль и вода
- 36. 4. Щелочь + соль = Химические свойства щелочей: Условия протекания реакции: 1). исходные вещества должны быть
- 37. Минута истории Какие основания получили алхимики?
- 38. Выполните задание. Допишите уравнения реакций. Назовите вещества. 1 ВАРИАНТ 1). NaOH + H2SO4 = 2). NaOH
- 39. Кто может о своей работе на уроке сказать: «Я сегодня на уроке не работал, отдыхал!»?
- 40. Кто может о своей работе на уроке сказать: «Я сегодня на уроке не все понял, потому
- 41. Кто может о своей работе на уроке сказать: «Я сегодня на уроке хорошо поработал! Все понял,
- 42. Д/З § 39, у. 2, 5, 6, 11* с. 174-175.
- 44. Скачать презентацию




































 Фотоальбом. Машенька
Фотоальбом. Машенька Международные и региональные торговые сети
Международные и региональные торговые сети Презентация к уроку Деление клетки. Митоз. естествознание-5 класс
Презентация к уроку Деление клетки. Митоз. естествознание-5 класс символы и эмблемы
символы и эмблемы Шаблоны презентаций - 5
Шаблоны презентаций - 5 Окна. Оконные проёмы. Варианты оформления
Окна. Оконные проёмы. Варианты оформления Методы оценки экономической эффективности инвестиционных проектов и их реализация в программном обеспечении
Методы оценки экономической эффективности инвестиционных проектов и их реализация в программном обеспечении G`alamat online school
G`alamat online school Система комп’ютерного моделювання процесів життєдіяльності органів і систем організму, Скіф
Система комп’ютерного моделювання процесів життєдіяльності органів і систем організму, Скіф Назначение, общее устройство и тактико-технические характеристики РСМ Р-166 (Р-166-0,5)
Назначение, общее устройство и тактико-технические характеристики РСМ Р-166 (Р-166-0,5) דור המייסדים - יונג ואדלר
דור המייסדים - יונג ואדלר Виды перевозок пассажиров автомобильным транспортом
Виды перевозок пассажиров автомобильным транспортом Бактериялар
Бактериялар Всемирный день без табака
Всемирный день без табака Функции рекламы и PR в организации
Функции рекламы и PR в организации Обустройство морских нефтегазовых месторождений
Обустройство морских нефтегазовых месторождений Основные теоремы магнитостатического поля
Основные теоремы магнитостатического поля Внутренние воды РТ
Внутренние воды РТ Генеральный план
Генеральный план prezentatsia
prezentatsia Управление экономической безопасности и противодействия коррупции. УЭБиПК УМВД России по Ульяновской области
Управление экономической безопасности и противодействия коррупции. УЭБиПК УМВД России по Ульяновской области Вопросы репродуктивного здоровья, современные методы обследования и лечения бесплодия
Вопросы репродуктивного здоровья, современные методы обследования и лечения бесплодия Современные технологии на уроках географии
Современные технологии на уроках географии Презентация Лоскутное шитье-неиссякаемый источник творчества
Презентация Лоскутное шитье-неиссякаемый источник творчества Гальваностегія. Приклад гальванізації сріблом (або золотом)
Гальваностегія. Приклад гальванізації сріблом (або золотом) Презентация День семьи
Презентация День семьи Новые подходы к изучению истории Великой Отечественной войны и их отражение в школьных учебниках
Новые подходы к изучению истории Великой Отечественной войны и их отражение в школьных учебниках Внутренние воды Пензенской области
Внутренние воды Пензенской области