Слайд 2
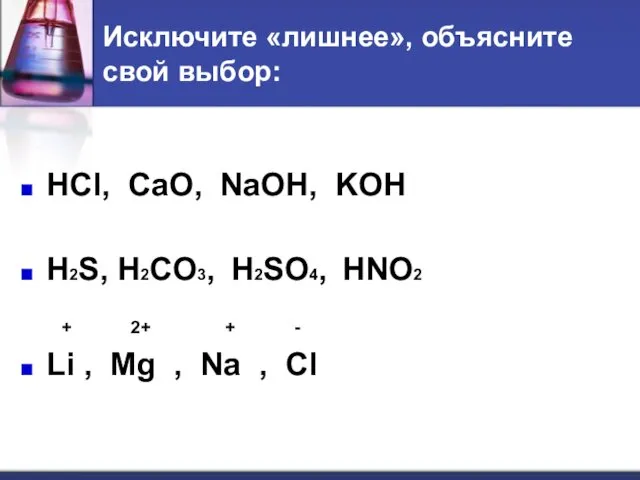
Исключите «лишнее», объясните свой выбор:
HCl, CaO, NaOH, KOH
H2S, H2CO3, H2SO4, HNO2
+ 2+ + -
Li , Mg , Na , Cl
Слайд 3

Найдите соответствие между характеристиками и формулами кислот:
1.Одноосновная, летучая, сильный электролит, кислородсодержащая.
2.Двухосновная,
нелетучая, сильный электролит, стабильная.
3.Двухосновная, нестабильная, слабый электролит.
А) H2SO4, Б) H2CO3, В) HCl, г) HNO3
Слайд 4

Определите, с какими металлами будет взаимодействовать разб. H2SO4:
1) Ag
2) Zn
3) Hg
4)
Cu
5) Mg
Запишите в тетради уравнение одной реакции
Слайд 5

Найдите и исправьте ошибки в следующих уравнениях:
K2CO3 +HCl = 2KCl +
H2O + CO2
+ 2- + - +
2K + CO3 + 2H + 2Cl = 2K + H2O +CO2
2-
2H + CO3 = H2O + CO2
Слайд 6

Найдите и исправьте ошибки в следующих уравнениях:
K2CO3 +2HCl = 2KCl +
H2O + CO2
+ 2- + - + -
2K +CO3 + 2H +2Cl =2K +2Сl+H2O +CO2
+ 2-
2H + CO3 = H2O + CO2
Слайд 7

Даны формулы веществ. Выпишите кислоты и назовите их:
HCl, NaOH, Ba(OH)2 ,
H3PO4,
H2S, Mg(OH)2, Al(OH)3, H2SO3,
HNO2
Слайд 8

Основания: классификация и свойства в свете ТЭД
Слайд 9

ПЛАН
1.Состав оснований
2.Классификация оснований
3.Химические свойства
а)щелочей
б)нерастворимых оснований
4.Применение оснований
Слайд 10

Слайд 11

Слайд 12
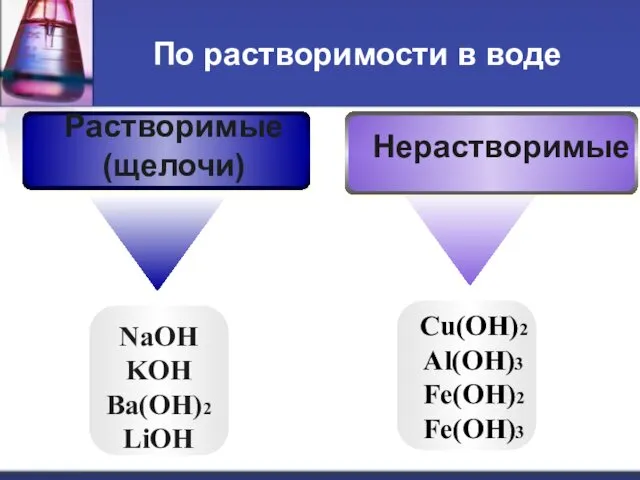
По растворимости в воде
NaOH
KOH
Ba(OH)2
LiOH
Cu(OH)2
Al(OH)3
Fe(OH)2
Fe(OH)3
Нерастворимые
Растворимые
(щелочи)
Слайд 13
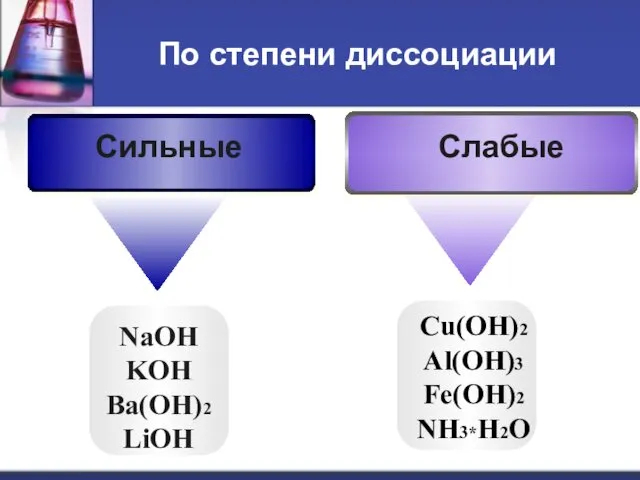
По степени диссоциации
NaOH
KOH
Ba(OH)2
LiOH
Cu(OH)2
Al(OH)3
Fe(OH)2
NH3*H2O
Слабые
Сильные
Слайд 14

По какому признаку основания разделены на группы?
NaOH
KOH
LiOH
СsOH
Cu(OH)2
Ba(OH)2
Pb(OH)2
Fe(OH)2
Al(OH)3
Fe(OH)3
?
?
?
Слайд 15
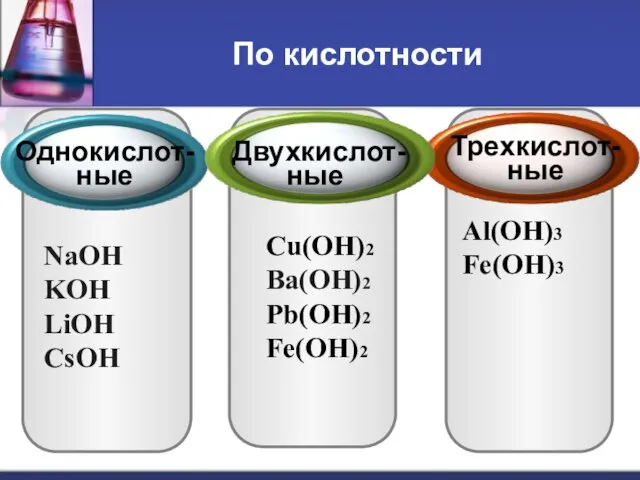
По кислотности
NaOH
KOH
LiOH
СsOH
Cu(OH)2
Ba(OH)2
Pb(OH)2
Fe(OH)2
Al(OH)3
Fe(OH)3
Однокислот-ные
Трехкислот-ные
Двухкислот-ные
Слайд 16
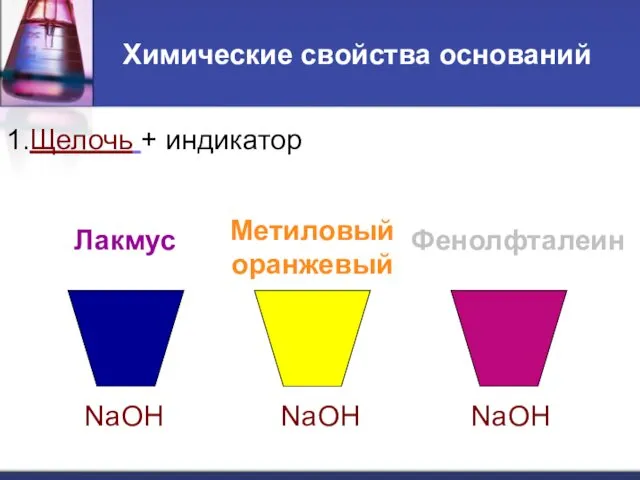
Химические свойства оснований
1.Щелочь + индикатор
Лакмус
Метиловый оранжевый
Фенолфталеин
NaOH
NaOH
NaOH
Слайд 17

Химические свойства оснований
2. Щелочь + соль, если образуется осадок или газ
NaOH + CuSO4
3. Щелочь + кислотный или амфотерный оксид
NaOH + SO2
4.Основание + кислота
Cu(OH)2 + H2SO4
5.Нерастворимое основание разлагается при нагревании
t
Cu(OH)2 =
Слайд 18

Слайд 19



















 Презентация к 180-летию Альфреда Нобеля
Презентация к 180-летию Альфреда Нобеля Konferentsia_17_02_22 (1)
Konferentsia_17_02_22 (1) Дидактический материал для преодоления нарушения слоговой структуры слова у детей 4-6 лет
Дидактический материал для преодоления нарушения слоговой структуры слова у детей 4-6 лет Европейский удильщик или морской черт
Европейский удильщик или морской черт Воспитание и обучение в Древней Индии
Воспитание и обучение в Древней Индии Потепление в СПБ или Зима без снега
Потепление в СПБ или Зима без снега Irregular verbs. Game
Irregular verbs. Game Основы программирования. Вложенные циклы
Основы программирования. Вложенные циклы Культура России первой половины 19 века
Культура России первой половины 19 века Философия и общественные науки в Новое и Новейшее время
Философия и общественные науки в Новое и Новейшее время Гpузовые стропы общего назначения
Гpузовые стропы общего назначения Происхождение Земли. (Лекция 6)
Происхождение Земли. (Лекция 6) Организация и ведение научно- исследовательской работы среди школьников
Организация и ведение научно- исследовательской работы среди школьников История троллейбуса БТЗ-5276-04
История троллейбуса БТЗ-5276-04 Я - выбираю спорт!
Я - выбираю спорт! Построение сложных запросов. Инсерт
Построение сложных запросов. Инсерт Социальные движения в первой половине XVIII века
Социальные движения в первой половине XVIII века Спасский Староярмарочный Собор. Моя малая Родина. Моё спасение
Спасский Староярмарочный Собор. Моя малая Родина. Моё спасение АНАЛИТИЧЕСКИЙ ОТЧЕТ о результатах итоговых контрольных работ
АНАЛИТИЧЕСКИЙ ОТЧЕТ о результатах итоговых контрольных работ Тема Родительское собрание
Тема Родительское собрание Усилители. Усилительный каскад на БПТ с ОЭ
Усилители. Усилительный каскад на БПТ с ОЭ проект учащегося 3 класса Четверткова Георгия
проект учащегося 3 класса Четверткова Георгия Наши дети – наше будущее
Наши дети – наше будущее Волейбол. Совершенствование нижней прямой подачи
Волейбол. Совершенствование нижней прямой подачи Метод координат
Метод координат Презентация для педагогов
Презентация для педагогов Приобщение детей к татарской и русской культуре в подготовительной группе детского сада
Приобщение детей к татарской и русской культуре в подготовительной группе детского сада Военно-морской флот Российской Федерации
Военно-морской флот Российской Федерации