Содержание
- 2. Цели урока Дать определение основаниям; Классифицировать основания; Ознакомиться с основными химическими свойствами растворимых и нерастворимых оснований.
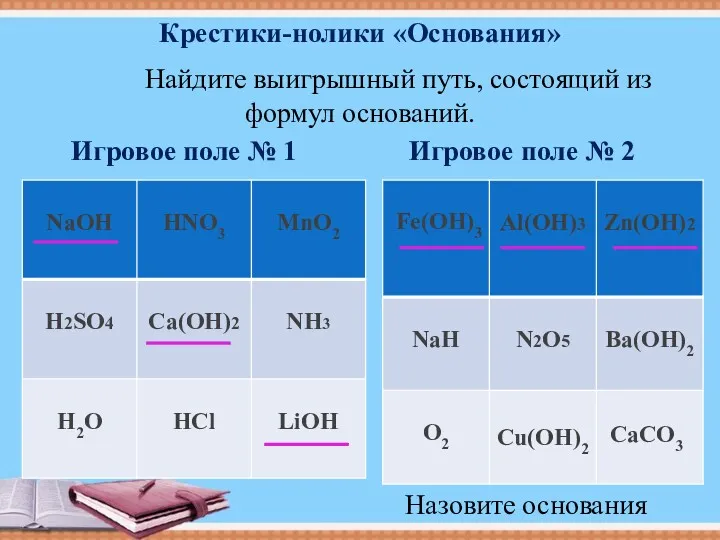
- 3. Игровое поле № 1 Игровое поле № 2 Назовите основания Крестики-нолики «Основания» Найдите выигрышный путь, состоящий
- 4. ОСНОВАНИЯМИ называют электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы ОН-: NaOH = Na+ +
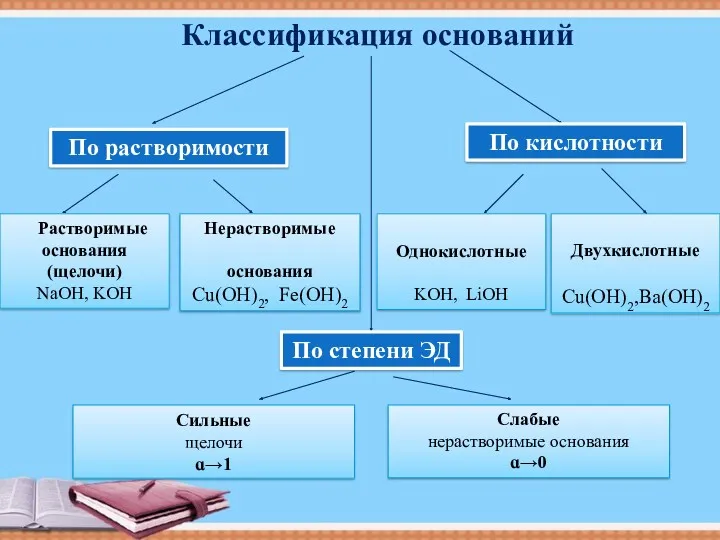
- 5. Классификация оснований По растворимости По кислотности По степени ЭД Растворимые основания (щелочи) NaOH, KOH Нерастворимые основания
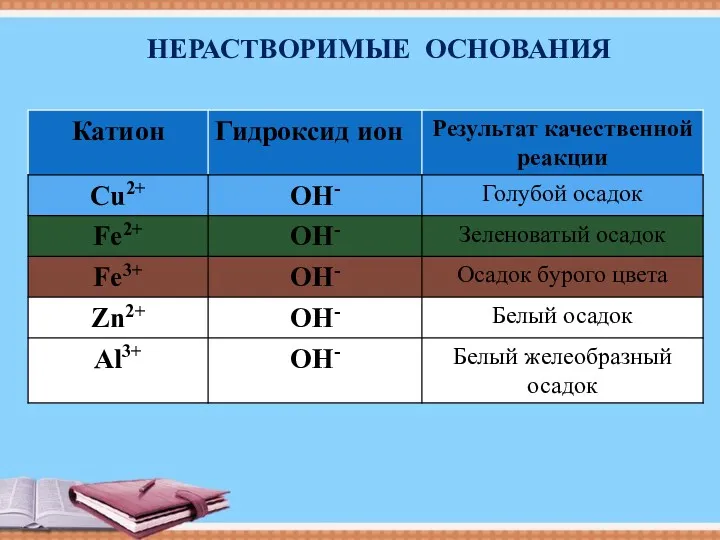
- 6. НЕРАСТВОРИМЫЕ ОСНОВАНИЯ
- 7. Действие на индикаторы ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
- 8. 2Al(ОН)3 + 3H2SO4 = Al2(SO4)3 + 6H2O 2Al(ОН)3+6H+ + 3SO42- =2Al3+ + 3SO42- + 6H2O Al(ОН)3
- 9. 2. Щелочь + Оксид неметалла →Соль + H2O (реакция обмена) 2NaOH + N2O5 = 2Na NO3+
- 10. 3. Щелочь +Соль → новая соль + новое основание (реакция обмена) Ba(ОН)2 + Na2SO4 = BaSO4↓+
- 11. Сu(OH)2 = CuO +H2O 2Fe(OH)3 = Fe2O3 + 3H2O 4.Нерастворимые основания (при нагревании) → → оксид
- 12. I. Тест 1.Формула основания это: а) NaOH б) HCl в) CuCl2 г) SO3 2. Метиловый оранжевый
- 13. II. Соотнесите
- 14. III. Какие вещества реагируют друг с другом? Выберите правильные ответы: а) Cu + NaOH = …
- 15. IV.Составить молекулярные, полные и сокращённые ионные уравнения химических реакций между следующими веществами: хлорид железа (III) и
- 17. Скачать презентацию











 презентация к уроку Мы изучаем Японию
презентация к уроку Мы изучаем Японию Статья - Готовность дошкольников массовых детских садов к обучению в школе
Статья - Готовность дошкольников массовых детских садов к обучению в школе Лукойл. Формы и стратегии М.Б
Лукойл. Формы и стратегии М.Б Мастер - класс Использование традиционной народной куклы в работе с детьми дошкольного возраста
Мастер - класс Использование традиционной народной куклы в работе с детьми дошкольного возраста Всероссийский образовательный Центр духовной и материальной исторической культуры Знаменка Великой княгини Анастасии Киевской
Всероссийский образовательный Центр духовной и материальной исторической культуры Знаменка Великой княгини Анастасии Киевской Транспортная и инфраструктурная система - Краснодар
Транспортная и инфраструктурная система - Краснодар Влияние цвета на здоровье человека
Влияние цвета на здоровье человека Анализ повреждений магистралей первичной сети и разработка мероприятий по сокращению времени проведения ремонтных работ
Анализ повреждений магистралей первичной сети и разработка мероприятий по сокращению времени проведения ремонтных работ Тест для школьников 4 класса по правилам дорожного движения.
Тест для школьников 4 класса по правилам дорожного движения. Сахар-песок в кондитерской промышленности
Сахар-песок в кондитерской промышленности Андрей Рублёв и Феофан Грек. Русская иконопись периода XIV-XV веков
Андрей Рублёв и Феофан Грек. Русская иконопись периода XIV-XV веков Учимся определять грибы
Учимся определять грибы Реконструкция электрических сетей здания. Технические решения и качество исполнения
Реконструкция электрических сетей здания. Технические решения и качество исполнения Балалар пульмонологиясындағы жедел жағдайлар. Жедел тыныс жетіспеушілігі, ларингоспазм, бронхоспазм, өкпелік қан кету
Балалар пульмонологиясындағы жедел жағдайлар. Жедел тыныс жетіспеушілігі, ларингоспазм, бронхоспазм, өкпелік қан кету Виртуальная выставка новых поступлений учебников. Основное общее образование
Виртуальная выставка новых поступлений учебников. Основное общее образование Микозы. Грибные заболевания кожи
Микозы. Грибные заболевания кожи Структура сайта
Структура сайта Описание опыта
Описание опыта Комплексна проробка рейсу Марсель (Франція) – Ломе (Того) під час перевезення вантажів у контейнерах
Комплексна проробка рейсу Марсель (Франція) – Ломе (Того) під час перевезення вантажів у контейнерах Нові підходи до лікування гострої респіраторної вірусної інфекції у дітей
Нові підходи до лікування гострої респіраторної вірусної інфекції у дітей Борьба с осложнениями в скважинах, оборудованных УЭЦН в условиях ЦДНГ №3 НГДУ Чекмагушнефть
Борьба с осложнениями в скважинах, оборудованных УЭЦН в условиях ЦДНГ №3 НГДУ Чекмагушнефть 16 ноября – день толерантности. Учимся слушать друг друга
16 ноября – день толерантности. Учимся слушать друг друга Польза танцев
Польза танцев Последовательный пересказ текста описательного характера с опорой на графические схемы. Рассказ Березка
Последовательный пересказ текста описательного характера с опорой на графические схемы. Рассказ Березка Информационные системы в ОЗ
Информационные системы в ОЗ Системы силовых установок. Тема 6
Системы силовых установок. Тема 6 Логика смены. Основные периоды. Особенности работы в нестандартные дни
Логика смены. Основные периоды. Особенности работы в нестандартные дни Устройства памяти компьютера
Устройства памяти компьютера