Содержание
- 2. Основні поняття термодинаміки Термодинаміка –наука, що вивчає енергію та закони її перетворення з одних видів в
- 3. Хімічна термодинаміка вивчає теплові ефекти хімічних реакцій і процесів. Технічна термодинаміка, основа інженерної теплотехніки, – розділ
- 4. Технічна термодинаміка ґрунтується на трьох основних законах (основах): першому, що являє собою застосування до теплових систем
- 5. Тепловий рух – безладний (хаотичний) рух мікрочастинок (молекул, атомів та ін.), з яких складаються всі тіла.
- 6. Термодинамічною системою називається сукупність макроскопічних тіл, що обмінюються енергією між собою і навколишнім середовищем (всіма іншими
- 7. Розрізняють рівноважний і нерівноважний стани термодинамічної системи. Рівноважним термодинамічним станом називають стан тіла чи системи, що
- 8. Стан термодинамічної системи, при якому значення параметрів у всіх її частинах лишаються незмінними в часі (через
- 9. Параметри стану – фізичні величини, що однозначно характеризують стан термодинамічної системи і не залежні від її
- 10. Тиск – фізична величина, чисельно рівна нормальній складовій сили, що діє на одиницю площі поверхні тіла.
- 11. Молекулярно-кінетична теорія газу дозволяє встановити зв'язок між тиском і кінетичною енергією теплового руху молекул газу, пари
- 12. Молекулярно-кінетична теорія газів встановлює пряму пропорційність між середньою кінетичною енергією поступального руху молекул і абсолютною температурою
- 13. Отже, абсолютна температура є мірою середньої кінетичної енергії поступального руху молекули і відноситься до всієї сукупності
- 14. Температура. Абсолютна температура робочого тіла – міра інтенсивності теплового руху молекул (завжди позитивна, її нульове значення
- 15. Числове значення термодинамічної абсолютної температури можна записати у вигляді :
- 16. Питомий об'єм робочого тіла (речовини) – це об'єм, який займає одиниця маси даної речовини, м3/кг
- 17. Термодинамічний процес – послідовна зміна стану тіла, що відбувається в результаті енергетичної взаємодії робочого тіла з
- 18. Основні параметри стану системи, що перебуває в термодинамічній рівновазі, зв'язані між собою, причому число незалежних параметрів
- 19. Таким чином, рівноважний стан термодинамічної системи повністю визначається значеннями двох незалежних змінних. У цьому випадку термодинамічна
- 20. В загальному випадку термодинамічні параметри поділяються на інтенсивні й екстенсивні: інтенсивні не залежать від розмірів і
- 21. Рівняння стану ідеального газу Висловлює зв'язок між параметрами рівноважного стану термодинамічної системи, який в загальному випадку
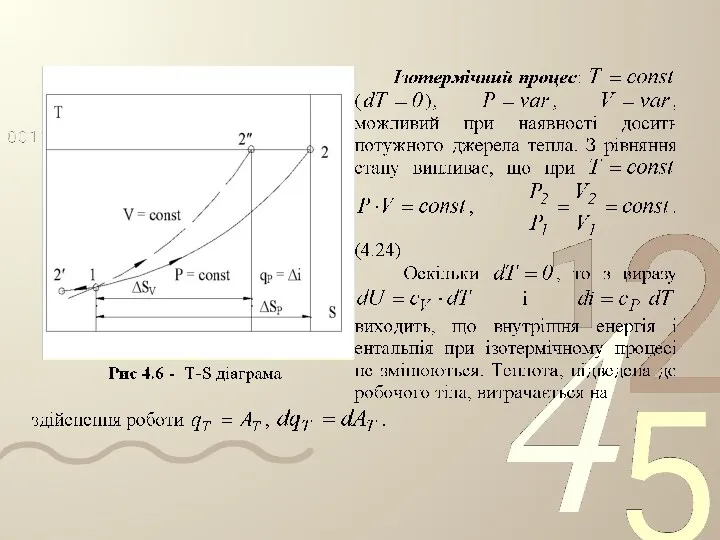
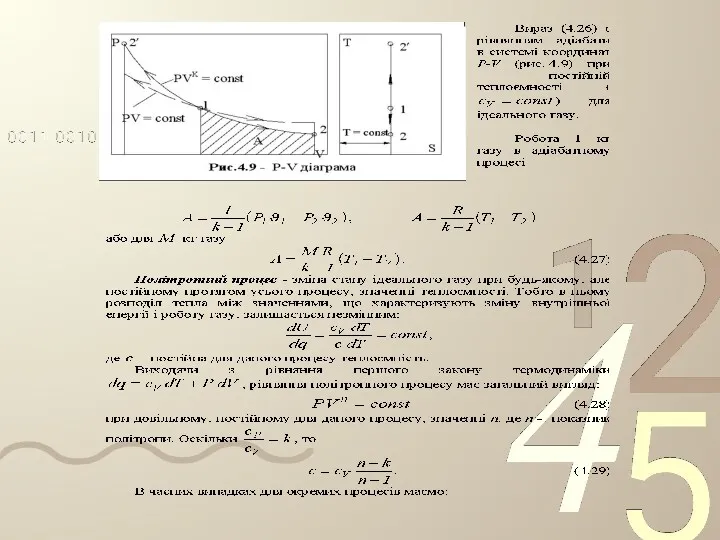
- 22. У технічній термодинаміці розглядаються наступні основні процеси: ізохорний – при постійному об'ємі; ізобарний – при постійному
- 23. Теплоємність газів Теплоємністю тіла називається кількість теплоти, яка необхідна для його нагрівання (або охолодження) на один
- 24. Загальна кількість теплоти, отримана в процесі, визначається наступним виразом:
- 25. Теплоємність ідеальних газів залежить від їхньої температури, атомності та характеру процесу. Теплоємність реальних газів залежить від
- 26. Перший та другий закони термодинаміки. Перший закон термодинаміки Базується на таких основних положеннях. Принцип еквівалентності теплоти
- 27. Внутрішня енергія робочого тіла - сукупність всіх видів енергії, тіла (системи тіл): Оскільки параметри пов'язані між
- 28. У технічній термодинаміці розглядаються процеси, в яких змінюється кінетична і потенціальна складові внутрішньої енергії. Температура газу
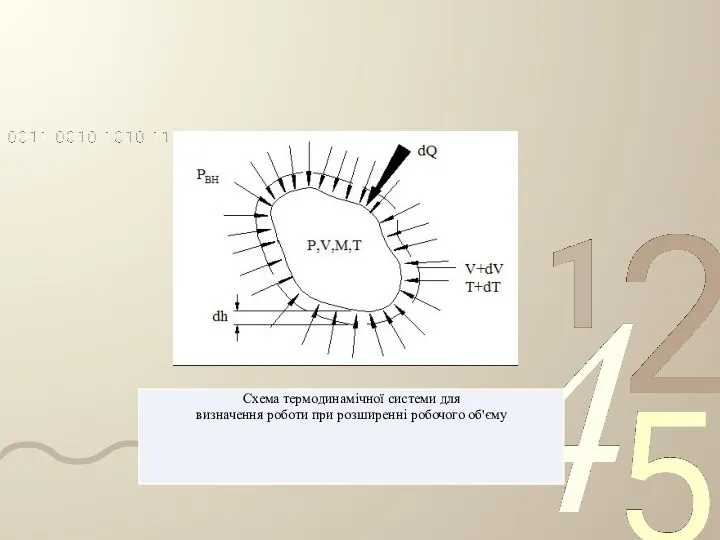
- 29. Робота робочого тіла . Розглянемо просту термодинамічну систему (ТС), в якій газ рухає поршень у циліндрі
- 30. Якщо поршень переміщується з дуже малою швидкістю, тобто весь процес розширення можна розбити на елементи dl,
- 31. Аналітичний вираз першого закону термодинаміки Нехай термодинамічна система масою M займає об'єм V при температурі T
- 32. Відповідно до рівняння Клапейрона підвищення температури при постійному тиску спричинить збільшення об'єму системи на величину dV
- 34. В ідеальних газах сили міжмолекулярного зчеплення не враховуються, тобто , і внутрішня енергія системи змінюється тільки
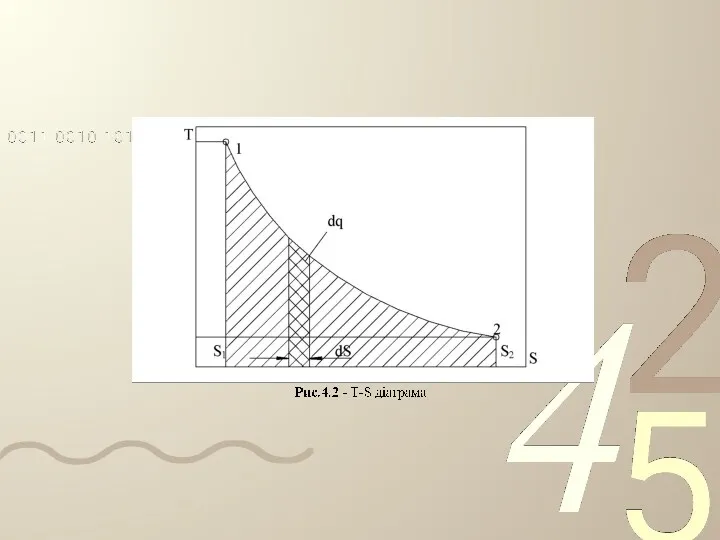
- 36. Функції стану робочого тіла Величини q і A, що характеризують зміну процесу робочого тіла, є не
- 42. Процеси зміни термодинамічного стану
- 52. Загальні питання дослідження процесів. Другий закон термодинаміки
- 54. Контрольні запитання
- 55. Водяна пара і її властивості
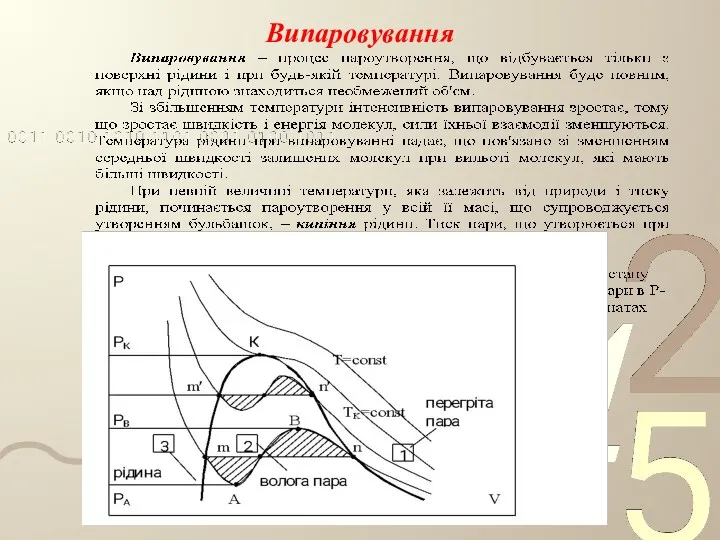
- 57. Випаровування
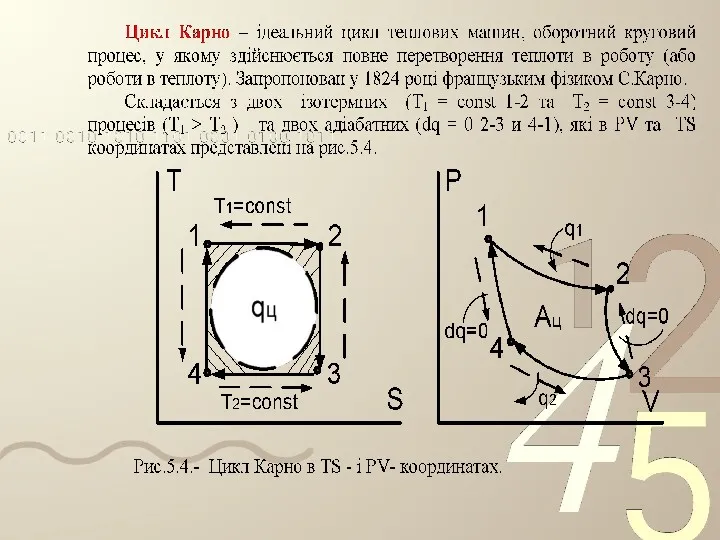
- 62. Термодинамічні цикли. Ідеальний цикл Карно
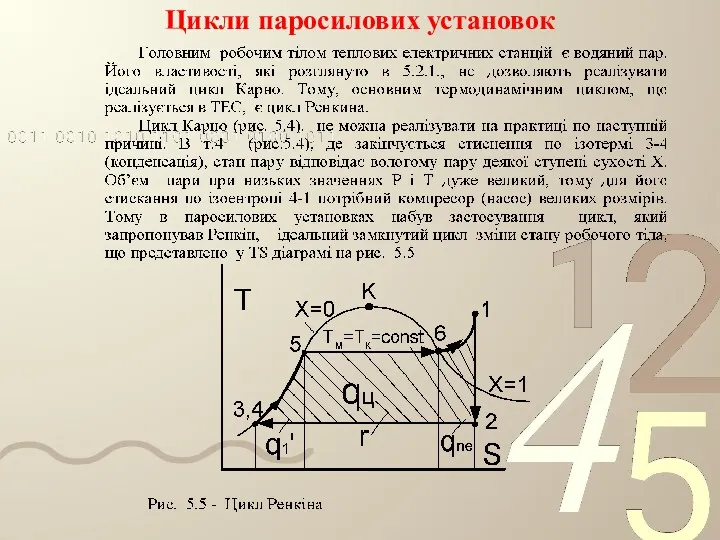
- 66. Цикли паросилових установок
- 69. Скачать презентацию



























































 Педагогические технологии на основе личностно-ориентированного подхода
Педагогические технологии на основе личностно-ориентированного подхода Конструкторское бюро 13.04-19.04
Конструкторское бюро 13.04-19.04 Неоплатонизм
Неоплатонизм Определение запаса насаждения
Определение запаса насаждения Дефекты сварных швов
Дефекты сварных швов Организация исследовательской деятельности учащихся на уроках математики.
Организация исследовательской деятельности учащихся на уроках математики. Повышение интереса к профессии сварщик
Повышение интереса к профессии сварщик Полевой отчёт ООО Нива
Полевой отчёт ООО Нива Презентация к семинару ИКТ на уроках английского языка 1 часть
Презентация к семинару ИКТ на уроках английского языка 1 часть Этапы развития жизни на земле
Этапы развития жизни на земле Борисова К. Н. 41-АН
Борисова К. Н. 41-АН Сущность и роль коммуникаций в системе управления
Сущность и роль коммуникаций в системе управления Меню на 02.06.15 по столовой ООО ЧАША. Завтрак
Меню на 02.06.15 по столовой ООО ЧАША. Завтрак Электрические станции и подстанции. Введение. Основные понятия, термины и определения
Электрические станции и подстанции. Введение. Основные понятия, термины и определения Медико-социальное сопровождение сирот
Медико-социальное сопровождение сирот Районный семинар школьных библиотекарей
Районный семинар школьных библиотекарей Термические повреждения, ожоги, отморожения, электротравма
Термические повреждения, ожоги, отморожения, электротравма Выдающиеся женщины-художницы
Выдающиеся женщины-художницы Игры для развития мелкой моторики своими руками.
Игры для развития мелкой моторики своими руками. Православные праздники на Руси
Православные праздники на Руси Демографическая ситуация в современной России
Демографическая ситуация в современной России Презентация Обучение дошкольников правилам дорожного движения
Презентация Обучение дошкольников правилам дорожного движения Моя улица
Моя улица Ремонт КДЦ
Ремонт КДЦ Использование нетрадиционной техники изобразительной деятельности в работе с детьми дошкольного возраста
Использование нетрадиционной техники изобразительной деятельности в работе с детьми дошкольного возраста Иероним Босх (около 1460-1516гг.)
Иероним Босх (около 1460-1516гг.) Презентация Художественное выпиливание
Презентация Художественное выпиливание Подготовка к ОГЭ по алгебре (базовая часть)
Подготовка к ОГЭ по алгебре (базовая часть)