Содержание
- 2. Один опыт я ставлю выше, чем тысячу мнений, рожденных только воображением. Математику уже за то любить
- 3. 1. Структура курса термодинамика и теплопередача Согласно учебного плана дисциплина относится к вариативной части блака1 и
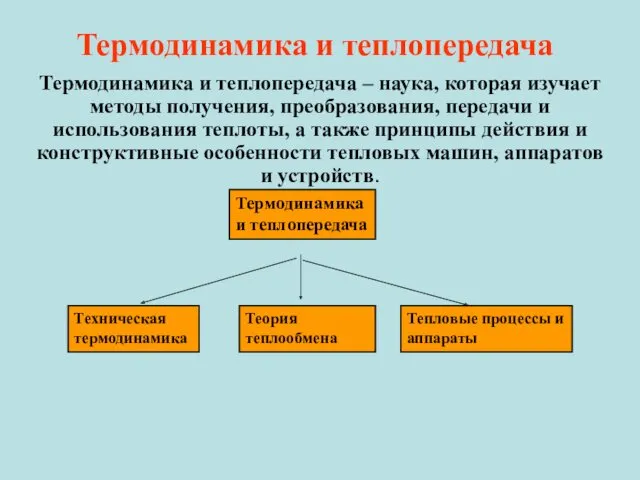
- 6. Термодинамика и теплопередача Термодинамика и теплопередача – наука, которая изучает методы получения, преобразования, передачи и использования
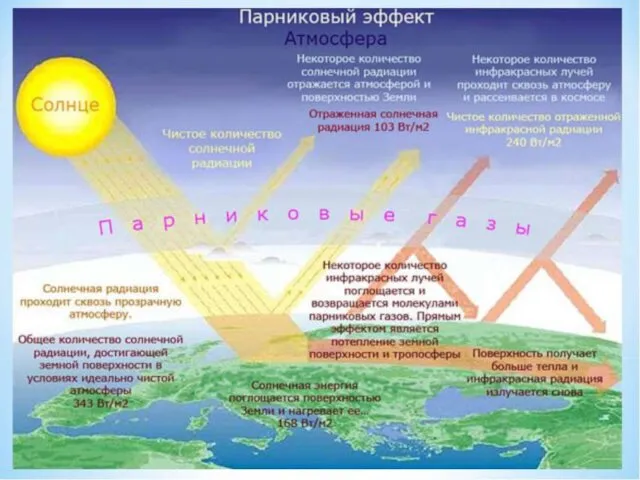
- 7. 2. Основные проблемы дисциплины парниковый эффект тепловое и химическое загрязнение окружающей среды. озоновые дыры.
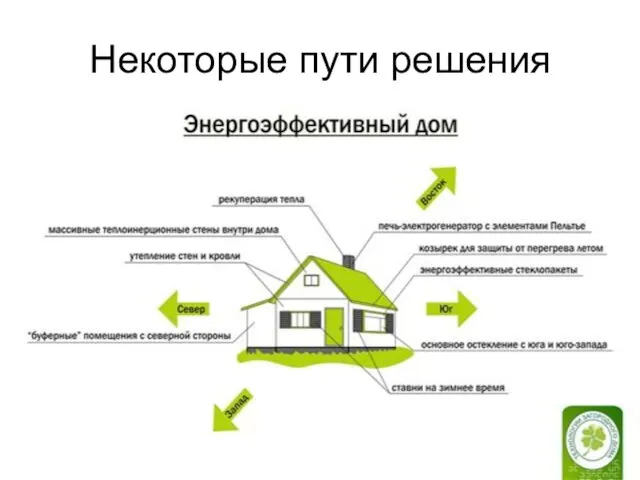
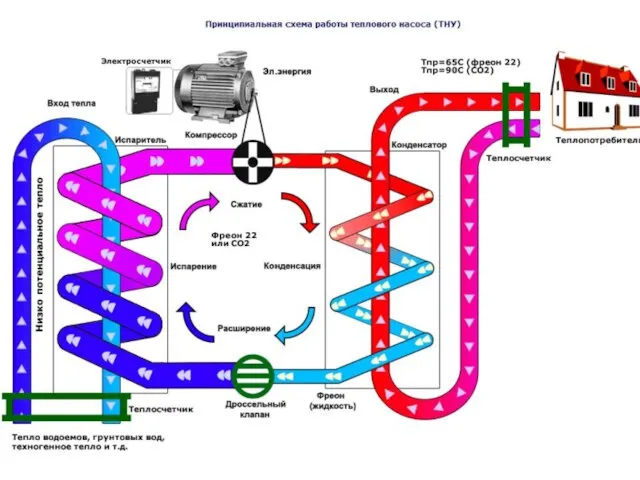
- 15. Некоторые пути решения
- 18. 3. Основные понятия и определения Исторически термодинамика возникла как наука, изучающая переход теплоты в механическую работу,
- 19. ИДЕАЛЬНЫЙ ГАЗ можно рассматривать как совокупность беспорядочно движущихся молекул-шариков, имеющих пренебрежимо малый собственный объем и не
- 20. ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА Базируется на трёх основных законах (началах) термодинамики и уравнении состояния: I закон термодинамики -
- 21. ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия,
- 22. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться энергией между собой и окружающей
- 23. Параметры состояния
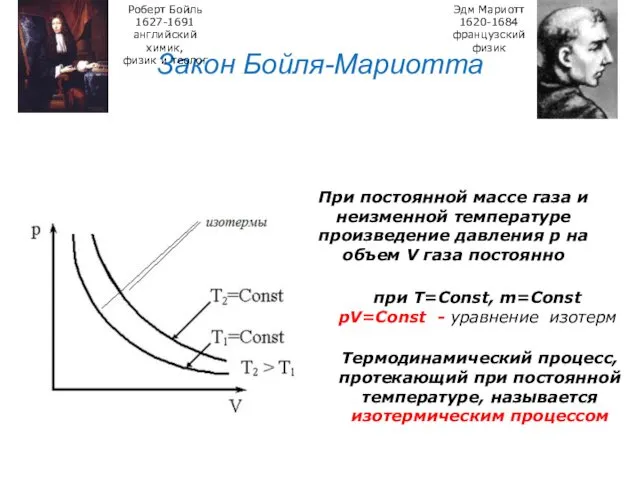
- 24. Закон Бойля-Мариотта Роберт Бойль 1627-1691 английский химик, физик и теолог Эдм Мариотт 1620-1684 французский физик При
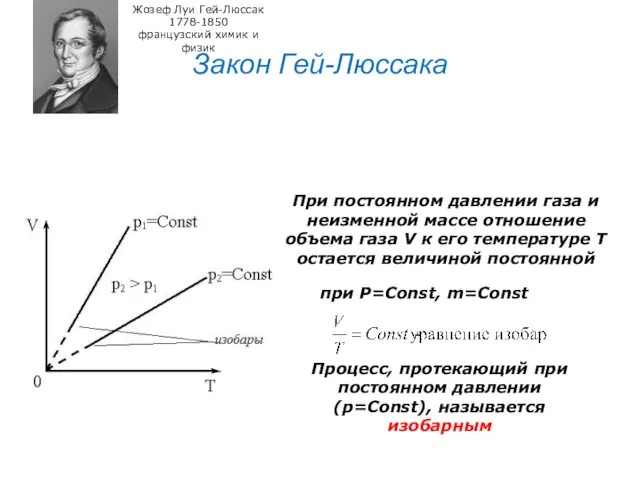
- 25. Закон Гей-Люссака Жозеф Луи Гей-Люссак 1778-1850 французский химик и физик При постоянном давлении газа и неизменной
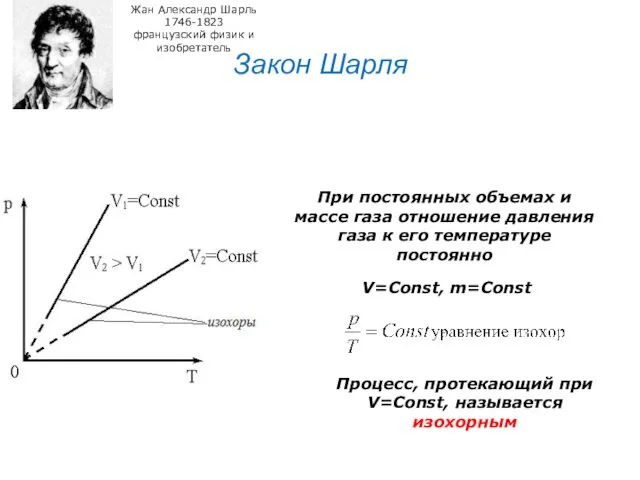
- 26. Закон Шарля Жан Александр Шарль 1746-1823 французский физик и изобретатель При постоянных объемах и массе газа
- 27. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1 , p2 ,…, pn входящих
- 28. Закон Авогадро СРЕДНЯЯ КИНЕТИЧЕСКАЯ ЭНЕРГИЯ поступательного движения одной молекулы идеального газа равна k≈1,38⋅10-23 Дж/К - Постоянная
- 29. УРАВНЕНИЕ МЕНДЕЛЕЕВА – КЛАПЕЙРОНА уравнение состояния идеального газа m – масса газа, μ –молярная масса газа
- 30. 4.Аналитическое выражение первого закона термодинамики ВНУТРЕННЕЙ ЭНЕРГИЕЙ вещества называется энергия U, зависящая от термодинамического состояния системы
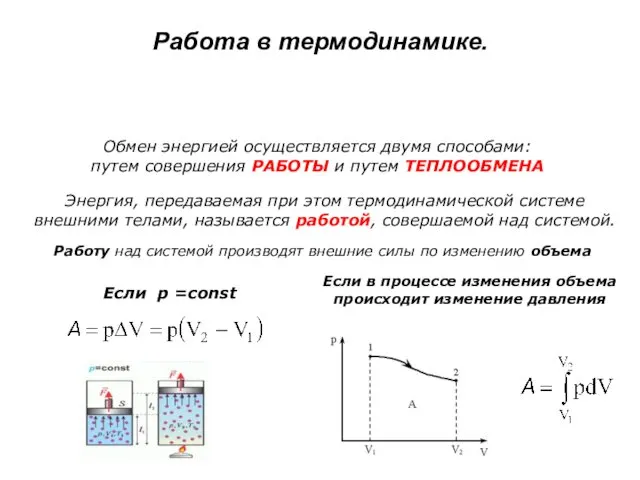
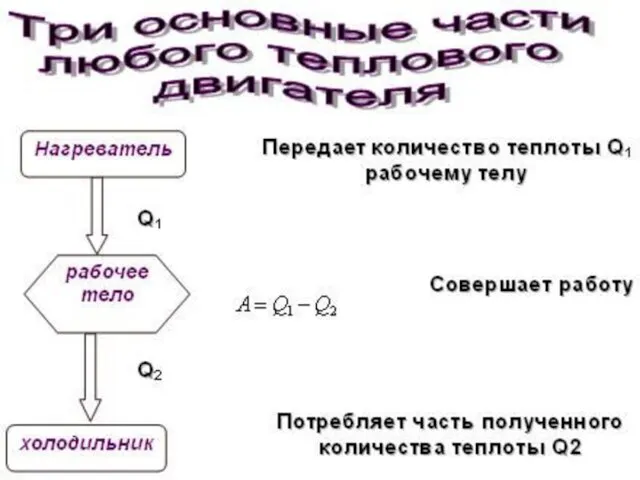
- 31. Работа в термодинамике. Обмен энергией осуществляется двумя способами: путем совершения РАБОТЫ и путем ТЕПЛООБМЕНА Энергия, передаваемая
- 32. Количество теплоты Теплообмен происходит между телами или частями одного и того же тела, нагретыми до различной
- 33. Первое начало термодинамики количество теплоты, сообщенное системе, расходуется на изменение внутренней энергии системы и на совершение
- 34. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ δQ=dU+ δA ПРИМЕНИТЕЛЬНО К ИЗОПРОЦЕССАМ В ИДЕАЛЬНЫХ ГАЗАХ Для изохорного процесса (V= Const)
- 35. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ δQ=dU+ δA ПРИМЕНИТЕЛЬНО К ИЗОПРОЦЕССАМ В ИДЕАЛЬНЫХ ГАЗАХ АДИАБАТНЫМ называется, термодинамический процесс, при
- 36. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ δQ=dU+ δA ПРИМЕНИТЕЛЬНО К ИЗОПРОЦЕССАМ В ИДЕАЛЬНЫХ ГАЗАХ Для изобарного процесса (p=const) Физический
- 37. 5. Второй закон термодинамики Французская академия наук с 1755 г. «раз и навсегда» объявила что не
- 39. Определения II закона термодинамики 1.Формулировка Клаузиуса: теплота самопроизвольно не может переходить от тела с меньшей температурой
- 40. Теорема Карно 3. Формулировка Карно (II закона термодинамики): Теорема Карно: КПД обратимых машин, работающих при одинаковых
- 41. 4. Формулировка ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ на основе понятия энтропии: ЭНТРОПИЯ замкнутой (теплоизолированной) системы не может убывать
- 43. Скачать презентацию































 Актуальные проблемы немецкой драмы
Актуальные проблемы немецкой драмы Травлення в ротовій порожнині та шлунку
Травлення в ротовій порожнині та шлунку Great Britain
Great Britain Численность населения России. Презентация.
Численность населения России. Презентация. Презентация Достопримечательности станицы Старощербиновской
Презентация Достопримечательности станицы Старощербиновской Орфография
Орфография Товарный знак. Сходство до степени смешения
Товарный знак. Сходство до степени смешения Роль транснационализации в мировом хозяйстве
Роль транснационализации в мировом хозяйстве Итоги работы инновационной площадки.
Итоги работы инновационной площадки. Коммерческое предложение на поставку автопогрузчика CHERY грузоподъемностью 3,5т
Коммерческое предложение на поставку автопогрузчика CHERY грузоподъемностью 3,5т Паллиативті көмек пен мейірбикелік күтімге мұқтаж науқастардың тамақтану ерекшеліктері
Паллиативті көмек пен мейірбикелік күтімге мұқтаж науқастардың тамақтану ерекшеліктері Правильное употребление деепричастий и причастий
Правильное употребление деепричастий и причастий Устное собеседование по русскому языку
Устное собеседование по русскому языку Закон и власть
Закон и власть Moldflow Analysis Report
Moldflow Analysis Report 20190706_prezentatsiya_po_rasskazu_potanina
20190706_prezentatsiya_po_rasskazu_potanina Гидропривод. Гидронасос
Гидропривод. Гидронасос Сочинение-рассуждение 15.2 ОГЭ по русскому языку
Сочинение-рассуждение 15.2 ОГЭ по русскому языку Мероприятия туристско-краеведческой направленности. Центр ДЮТТИТ Пушкинского района Санкт-Петербурга
Мероприятия туристско-краеведческой направленности. Центр ДЮТТИТ Пушкинского района Санкт-Петербурга Презентация к уроку: Классификация кислородсодержащих органических веществ
Презентация к уроку: Классификация кислородсодержащих органических веществ Өндірістік практика бойынша есеп Орал
Өндірістік практика бойынша есеп Орал Презентация по чтению 3 класс
Презентация по чтению 3 класс Матрешка
Матрешка Сүт өнімдері биотехнологиясы
Сүт өнімдері биотехнологиясы Происхождение домашних собак
Происхождение домашних собак Толкование священого писания
Толкование священого писания Методы анализа переходных процессов. Классический метод
Методы анализа переходных процессов. Классический метод Организм человека
Организм человека