Содержание
- 2. Цели урока: Обучающие: изучить строение основных соединений серы; изучить распространение соединений серы в природе, применение основных
- 3. Основные соединения серы: Н2S – сероводород; SO2 - серный газ; SO3 -сернистый ангидрид; Н2SO3 - сернистая
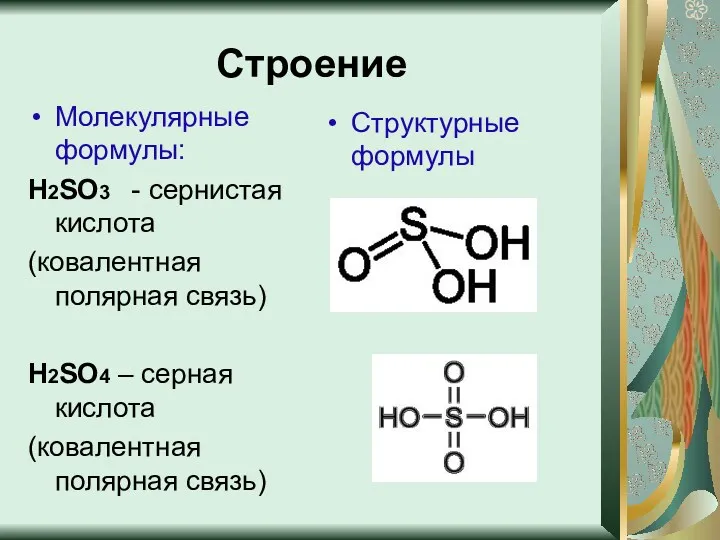
- 4. Строение Молекулярные формулы: Н2SO3 - сернистая кислота (ковалентная полярная связь) Н2SO4 – серная кислота (ковалентная полярная
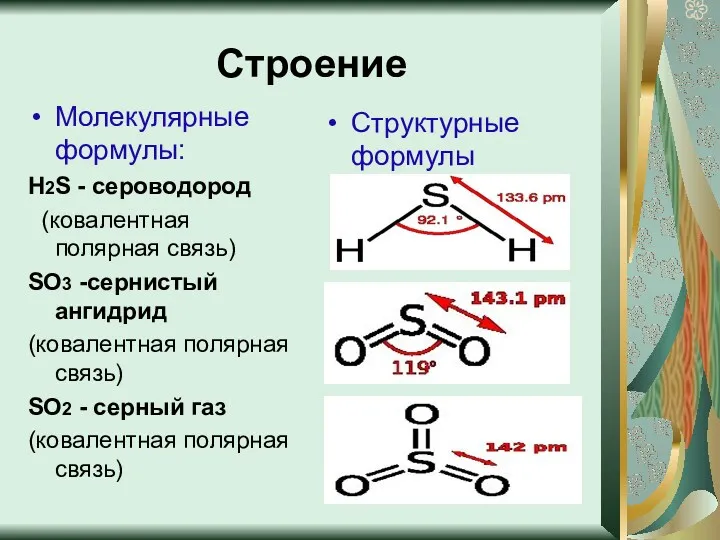
- 5. Строение Молекулярные формулы: Н2S - сероводород (ковалентная полярная связь) SO3 -сернистый ангидрид (ковалентная полярная связь) SO2
- 6. Гидросульфиды NaHS- гидросульфид натрия Ba(HS)2- гидросульфид бария Сульфиды Na2S – сульфид натрия ZnS – сульфид цинка
- 7. Серная кислоты – H2SO4 Плотность серной кислоты – 1,84 г /см3, Концентрированная серная кислота – это
- 9. СЕРОВОДОРОД Бесцветный газ с резким запахом тухлых яиц Термически неустойчив, плохо растворим в воде. Лучше, чем
- 10. Сернистый газ SO2 – сернистый газ. Очень токсичен. В нормальных условиях представляет собой бесцветный газ с
- 11. H2S является очень слабой кислотой: H2S → HS− + H+ Сероводород — сильный восстановитель. На воздухе
- 12. SO3 — типичный кислотный оксид, ангидрид серной кислоты 1. Кислотно-основные: При взаимодействии с водой образует серную
- 14. Нахождение соединений серы в природе Самородная сера Сульфидная сера Сульфатная сера Киноварь HgS PbS Галенит CuFeS2
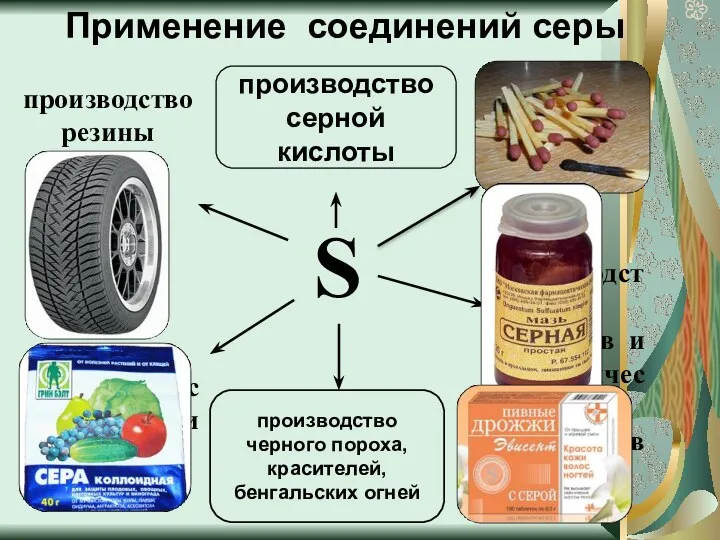
- 15. Применение соединений серы S производство лекарств и косметических препаратов для борьбы с вредителями растений производство резины
- 17. Скачать презентацию











 Дом. Мебель
Дом. Мебель Диагностика и лечение синкопальных состояний
Диагностика и лечение синкопальных состояний Часть речи глагол. Повторение
Часть речи глагол. Повторение Подготовка к ГИА (часть В). Умение оценивать количественные параметры информационных объектов
Подготовка к ГИА (часть В). Умение оценивать количественные параметры информационных объектов Обеспечение целостности БД
Обеспечение целостности БД Food
Food Источники энергии и пути ее превращений в организме
Источники энергии и пути ее превращений в организме презентация на тему Древнерусская литература
презентация на тему Древнерусская литература Этапы ухода за кожей
Этапы ухода за кожей НОД Познание -Писатели детям
НОД Познание -Писатели детям Фотоальбом дефектов сварных соединений по визуальному и измерительному контролю
Фотоальбом дефектов сварных соединений по визуальному и измерительному контролю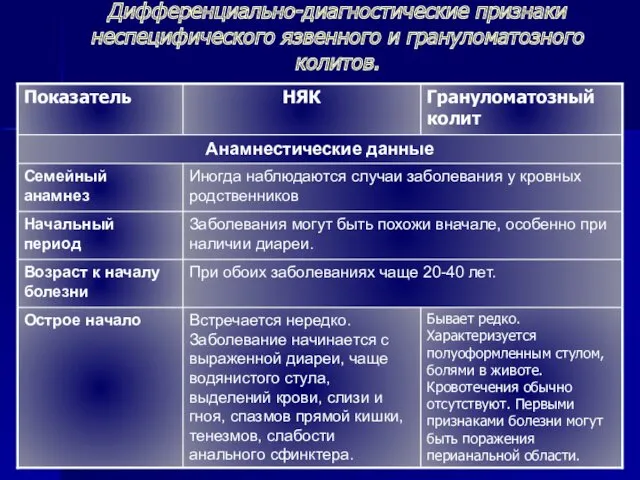 Дифференциально-диагностические признаки неспецифического язвенного и грануломатозного колитов
Дифференциально-диагностические признаки неспецифического язвенного и грануломатозного колитов Брендинг
Брендинг Клеточная теория. Типы клеточной организации
Клеточная теория. Типы клеточной организации Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах
Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах Технологии бурения наклонно-направленных скважин
Технологии бурения наклонно-направленных скважин Факторы стратификации в современной России
Факторы стратификации в современной России Первый член Символа веры. Вера
Первый член Символа веры. Вера Бурятская сказка
Бурятская сказка Крепкий алкоголь
Крепкий алкоголь Skanners & printers
Skanners & printers Презентация За избирателем-будущее России!
Презентация За избирателем-будущее России! Б.Ф. Шахов нима коми культура шӧрин
Б.Ф. Шахов нима коми культура шӧрин Объект, предмет, функции и принципы педагогики досуга
Объект, предмет, функции и принципы педагогики досуга презентация Болотов-педагог
презентация Болотов-педагог Наука о природе лесных пожаров и их последствий
Наука о природе лесных пожаров и их последствий О поощрении и наказании
О поощрении и наказании Опытно-эксперементальная деятельность по теме: Вода
Опытно-эксперементальная деятельность по теме: Вода