Содержание
- 2. Литература Теплотехника: Учебное пособие. (Миняев Ю.Н. и др.) УГГУ, 2009. – 202 с.
- 3. Литература Баскаков А.П. и др. Теплотехника. – М.: Энергоатомиздат, 1991г. – 224 с.
- 4. Литература Лариков Н.Н. Теплотехника. (Учебник для вузов) – М.: Стройиздат, 1985г. – 432 с.
- 5. Теплотехника - общеинженерная дисциплина, изучающая методы получения, преобразования, передачи и использования теплоты и связанные с этим
- 6. Изучить методы и способы: 1) Получения 2) Преобразования 3) Передачи 4) Использования теплоты и связанные с
- 7. Раздел 1 ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
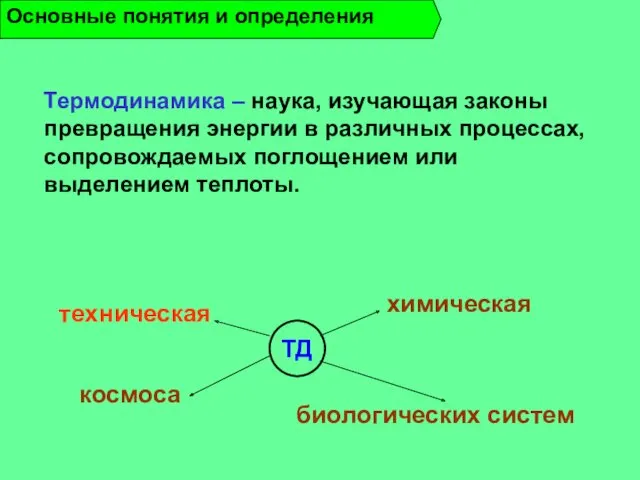
- 8. Термодинамика – наука, изучающая законы превращения энергии в различных процессах, сопровождаемых поглощением или выделением теплоты. Основные
- 9. Техническая ТД – наука, которая изучает тепловые процессы, протекающие в тепловых двигателях и установках: а) устанавливает
- 10. В термодинамике используется феноменологический метод изучения равновесных физических систем. База термодинамики – три основных закона!!! Основные
- 11. Основные понятия и определения ВСЕЛЕННАЯ МОЛЕКУЛЫ МЕТОДЫ ТЕРМОДИНАМИКИ
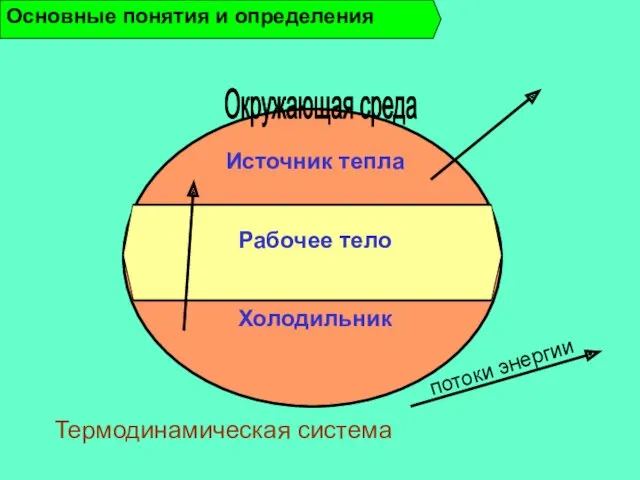
- 12. Термодинамическая система – совокупность материальных тел, находящихся в энергетическом взаимодействии между собой и окружающей средой. Изолированная
- 13. Источник тепла Рабочее тело Холодильник Основные понятия и определения Окружающая среда Термодинамическая система потоки энергии
- 14. Рабочее тело - вещество, способное воспринимать и отдавать теплоту, а также совершать работу. Термодинамические параметры состояния
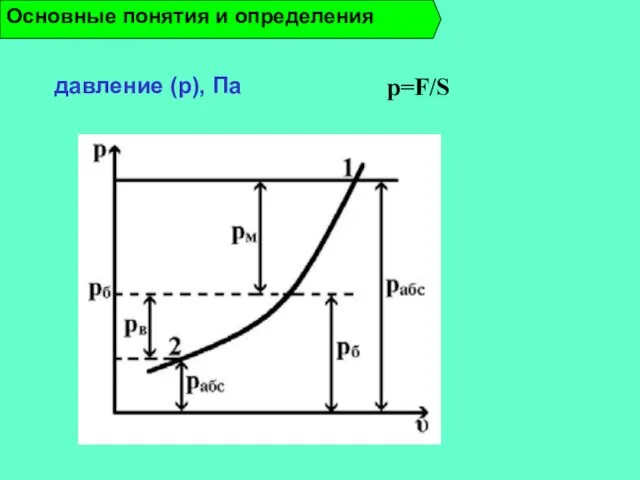
- 15. давление (p), Па Основные понятия и определения p=F/S
- 16. В соответствии с молекулярно-кинетической теорией: Основные понятия и определения
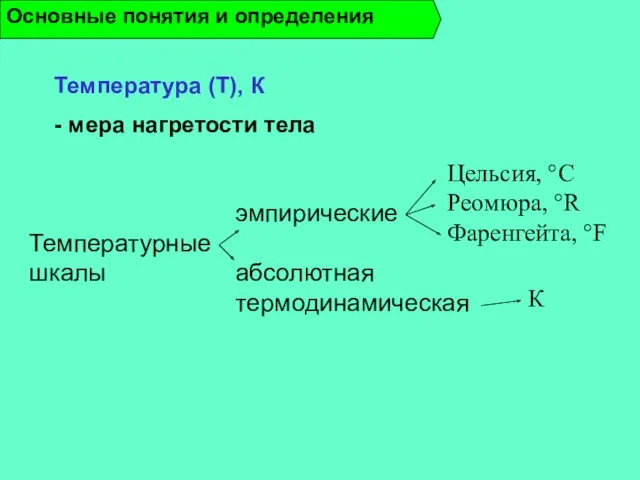
- 17. Температура (Т), К - мера нагретости тела Основные понятия и определения Температурные шкалы эмпирические абсолютная термодинамическая
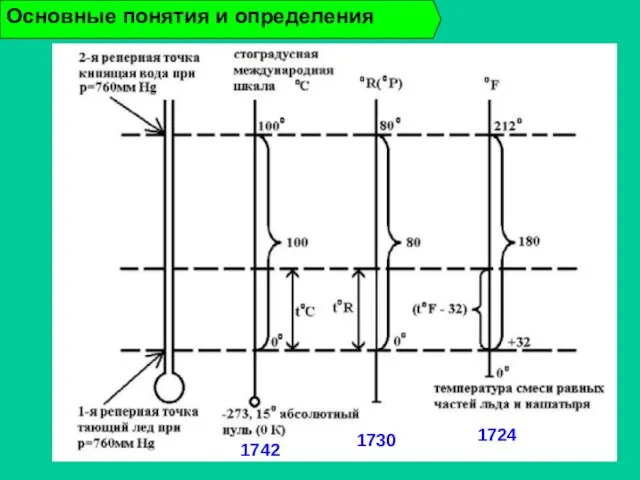
- 18. Основные понятия и определения 1730 1742 1724
- 19. Температура и движение молекул
- 20. В соответствии с молекулярно-кинетической теорией: Основные понятия и определения Дж/К – постоянная Больцмана; - кинетическая энергия
- 21. Удельный объем (v) – величина обратная плотности: м3/кг. Основные понятия и определения v = 1/ρ v
- 22. Равновесное состояние системы – все ТД параметры постоянны во времени и одинаковы во всех точках системы.
- 23. Основные понятия и определения
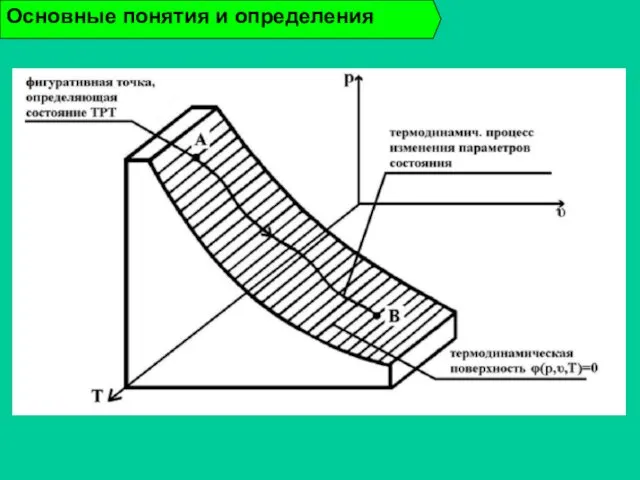
- 24. Термодинамический процесс - изменение состояния термодинамической системы во времени. Равновесный процесс - процесс, в котором все
- 25. Идеальный газ – газ, в котором: нет сил взаимного притяжения между молекулами; 2) их объем равен
- 26. Уравнение состояния Уравнение Клапейрона - функциональная связь между параметрами состояния для равновесной термодинамической системы. Уравнение Менделеева
- 27. Уравнение состояния Закон Авогадро: в равных объёмах различных газов при одинаковых температурах и давлениях содержится одинаковое
- 28. Уравнение состояния Универсальная газовая постоянная Для н.у. pн=760 мм.рт.ст.=0,1013 МПа, Vμ=22,4 м3/кмоль, Тн=273°К Дж/кмоль⋅К (8,314 кДж/кмоль⋅К)
- 29. Уравнение состояния Дж/кг⋅К Удельная газовая постоянная R любого газа: (Дж/кг⋅К )
- 30. Применение уравнения состояния Задача. Компрессор всасывает в 1 мин 3 м3 воздуха при t=15° C и
- 32. Скачать презентацию






















 Машины для основной обработки почвы
Машины для основной обработки почвы Научно-практический семинар: Обучение, воспитание и коррекция детей с умственной отсталостью в условиях инклюзивного образования
Научно-практический семинар: Обучение, воспитание и коррекция детей с умственной отсталостью в условиях инклюзивного образования отчет об исследовательской работе учащихся по краеведению.
отчет об исследовательской работе учащихся по краеведению. Курская битва
Курская битва Агитбригада по пожарной безопасности
Агитбригада по пожарной безопасности История возникновения, развития и перспективы космонавтики
История возникновения, развития и перспективы космонавтики Технология обслуживания в гостинице
Технология обслуживания в гостинице Внутренние воды Евразии.
Внутренние воды Евразии. Исчисление предикатов
Исчисление предикатов Герой ВОВ, Орлов Тимофей Николаевич
Герой ВОВ, Орлов Тимофей Николаевич Игра Сказочка-указочка презентация
Игра Сказочка-указочка презентация Магнитотеллурический метод в геофизике. (Лекция 7.6)
Магнитотеллурический метод в геофизике. (Лекция 7.6) Урок технологии Работа с бумагой. Плетение из полос бумаги. Коврик.
Урок технологии Работа с бумагой. Плетение из полос бумаги. Коврик. Арктические пустыни. Климатические условия
Арктические пустыни. Климатические условия Конструкция и компоненты абразивных материалов VSM
Конструкция и компоненты абразивных материалов VSM Интернет-журнал Звезда
Интернет-журнал Звезда Феномен любви
Феномен любви Портфолио волонтёрского отряда Инициатива
Портфолио волонтёрского отряда Инициатива Начало и конец презентации
Начало и конец презентации БИОЛОГИЯ И ХИМИЯ ПРОТИВ ВРЕДНОЙ ПРИВЫЧКИ
БИОЛОГИЯ И ХИМИЯ ПРОТИВ ВРЕДНОЙ ПРИВЫЧКИ №27 Образы борьбы и победы
№27 Образы борьбы и победы ФГТ
ФГТ Монтаж внутренних санитарно-технических систем
Монтаж внутренних санитарно-технических систем Зимний олимпийский вид спорта – лыжный спорт
Зимний олимпийский вид спорта – лыжный спорт Обучение грамоте дошкольников. Викторина
Обучение грамоте дошкольников. Викторина Организация работы с детьми с ОВЗ в условиях инклюзивного образование
Организация работы с детьми с ОВЗ в условиях инклюзивного образование Здоровый образ жизни в Республике Коми.
Здоровый образ жизни в Республике Коми. Проект: Дом будущего
Проект: Дом будущего