Содержание
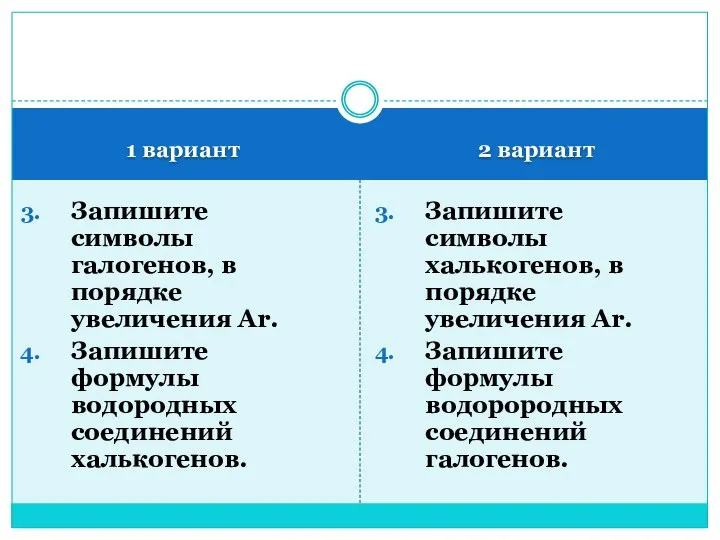
- 2. 1 вариант 2 вариант Запишите символы галогенов, в порядке увеличения Ar. Запишите формулы водородных соединений халькогенов.
- 3. 1 вариант 2 вариант Li, Na, K, Rb MgO, CaO, SrO, BaO, Mg(OH)2, Ca(OH)2, Sr(OH)2, Ba(OH)2
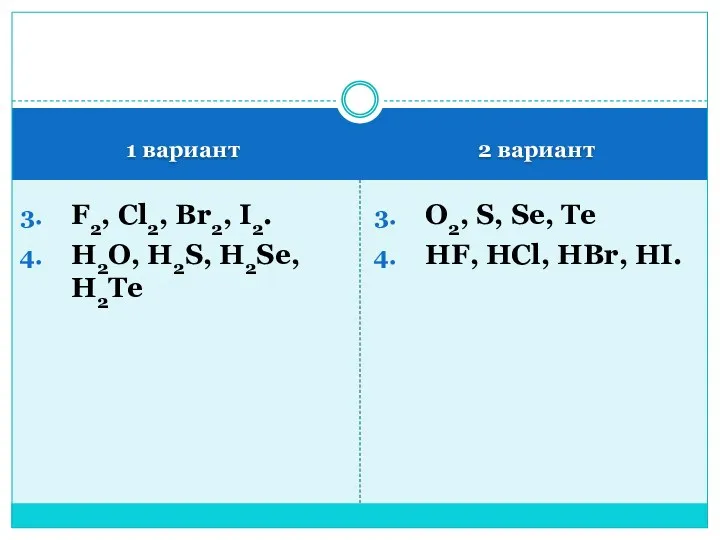
- 4. 1 вариант 2 вариант F2, Cl2, Br2, I2. H2O, H2S, H2Se, H2Te O2, S, Se, Te
- 5. 04.03.2013 г. Периодический закон Д.И. Менделеева
- 6. Работы предшественников Й. Берцелиус (Металлы и неметаллы) И.В. Деберейнер (Триады) Д.А.Р. Ньюлендс (Октавы) Л.Мейер
- 7. Й. Берцелиус Металлы Неметаллы Классификация химических элементов
- 8. И.В. Деберейнер Закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и
- 9. Д.А.Р. Ньюлендс Закон октав Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов,
- 10. Л.Мейер Опубликовал свою первую таблицу, в которую включены 42 элемента (из 63), размещённые в шесть столбцов
- 11. В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу периодический закон химических
- 12. Д.И. Менделеев расположил элементы в порядке возрастания атомных масс в ряд: Li, Be, … O, F,
- 13. Свойства элементов, а также и свойства образуемых ими простых и сложных веществ находятся в периодической зависимости
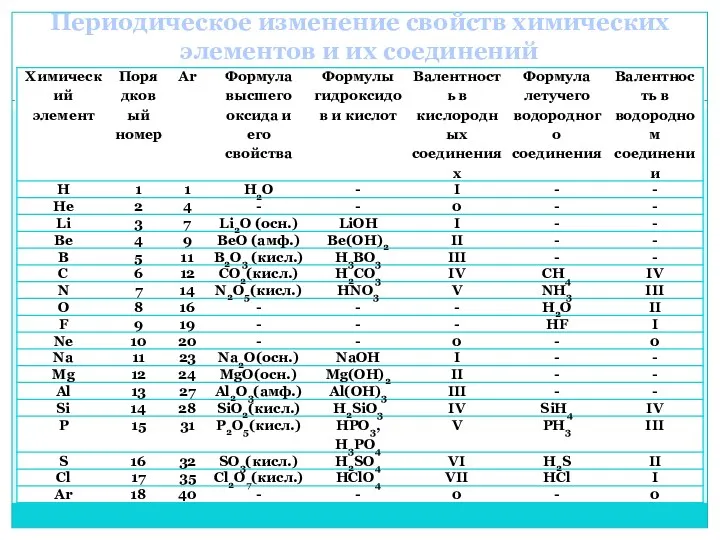
- 14. Периодическое изменение свойств химических элементов и их соединений
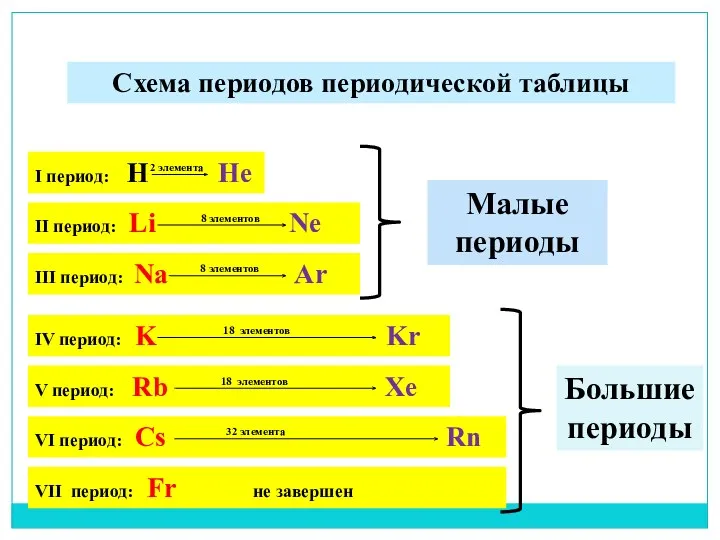
- 15. Период Ряд химических элементов, расположенных в прядке возрастания атомных масс. Период начинается металлом и заканчивается инертным
- 16. I период: H He 2 элемента Схема периодов периодической таблицы II период: Li Ne 8 элементов
- 17. В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов и применение её к указанию
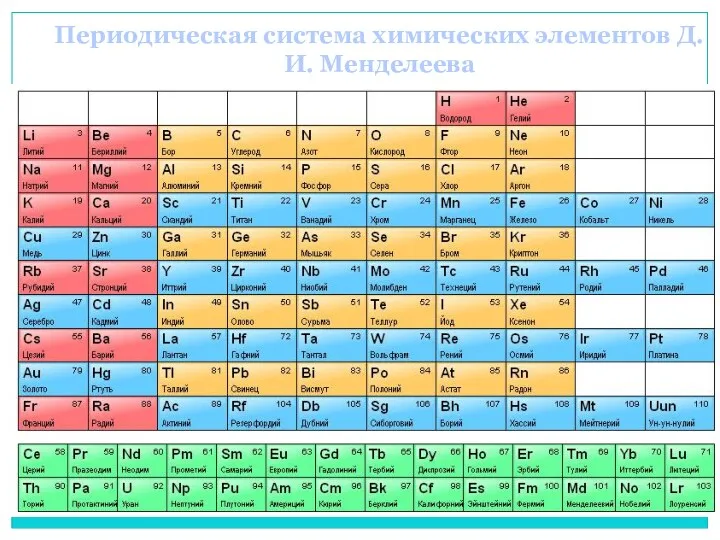
- 18. Периодическая система химических элементов Д.И. Менделеева
- 19. В приведенном ряду химических элементов: Li – Be – В – C – N – O
- 20. Найдите в ПСХЭ элементы с порядковыми номерами: 11, 12, 13, 14: Как изменяются химические свойства простых
- 21. Проверяем: Металлические свойства уменьшаются, валентность возрастает; Na2O, NaOH, MgO, Mg(OH)2, Al2O3, Al(OH)3, SiO2, H2SiO3 Металлические свойства
- 23. Скачать презентацию















 Принципиальная схема неблочной ТЭЦ с поперечными связями. Лекция 6
Принципиальная схема неблочной ТЭЦ с поперечными связями. Лекция 6 Классный час День матери
Классный час День матери Освящение храма в честь иконы Божией Матери Призри на смирение
Освящение храма в честь иконы Божией Матери Призри на смирение Театр будущего и будущее театра
Театр будущего и будущее театра Кисты челюстно-лицевой областей у детей. Одонтогенные воспалительные кисты челюстей от временных зубов у детей
Кисты челюстно-лицевой областей у детей. Одонтогенные воспалительные кисты челюстей от временных зубов у детей Кижинга, долина субурганов
Кижинга, долина субурганов Verb to be
Verb to be Автоматика Carel
Автоматика Carel Сортировочные станции
Сортировочные станции Проект Город детства. Преобразование развивающей предметно- пространственной среды групп в соответствии с ФГОС ДО.
Проект Город детства. Преобразование развивающей предметно- пространственной среды групп в соответствии с ФГОС ДО. Самарская офтальмологическая клиника
Самарская офтальмологическая клиника Решение систем линейных неравенств. 8 класс
Решение систем линейных неравенств. 8 класс Таможенный менеджмент. Основные понятия и определения
Таможенный менеджмент. Основные понятия и определения Родительское собрание в 1 классе 1 четверть
Родительское собрание в 1 классе 1 четверть История нашего города. Санкт-Петербург 1703 год
История нашего города. Санкт-Петербург 1703 год Оснащение переезда
Оснащение переезда Анализ конкурентов. Пошаговый метод с разъяснением
Анализ конкурентов. Пошаговый метод с разъяснением Participle I, II. Причастия в английском языке
Participle I, II. Причастия в английском языке A Time to Celebrate (Традиционные празднества)
A Time to Celebrate (Традиционные празднества) Европейский Север
Европейский Север Управление проектами. Стандарты управления проектами
Управление проектами. Стандарты управления проектами Система взаимодействия власти и общества
Система взаимодействия власти и общества Профессия метеоролога
Профессия метеоролога Программа развития воспитательной системы Мастерская детского успеха
Программа развития воспитательной системы Мастерская детского успеха Минеральные источники РФ и Республики Мордовия
Минеральные источники РФ и Республики Мордовия Программа деятельности классного руководителя коррекционной школы-интерната VIII вида Мастерская добрых дел
Программа деятельности классного руководителя коррекционной школы-интерната VIII вида Мастерская добрых дел Трехфазные и специальные трансформаторы
Трехфазные и специальные трансформаторы крылатые выражения из романа Евгений Онегин
крылатые выражения из романа Евгений Онегин