Содержание
- 2. Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По мере открытия новых химических элементов,
- 3. В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных
- 4. При переходе от лития к фтору происходит закономерное ослабление металлических свойств и усиление неметаллических. При переходе
- 5. Если написать ряды один под другим так, чтобы под литием находился натрий, а под неоном –
- 6. Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
- 7. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной
- 8. Уязвимым моментом периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с
- 9. Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что
- 10. Открытый Д. И. Менделеевым закон и построенная на основе закона периодическая система элементов - это важнейшее
- 11. Периодическая таблица химических элементов Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на
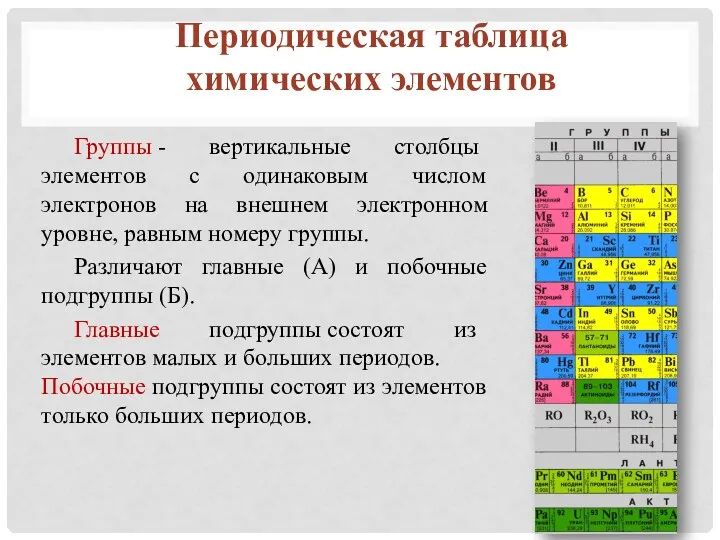
- 12. Периодическая таблица химических элементов Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном
- 13. Поскольку окислительно – восстановительные свойства атомов оказывают влияние на свойства простых веществ и их соединений, то
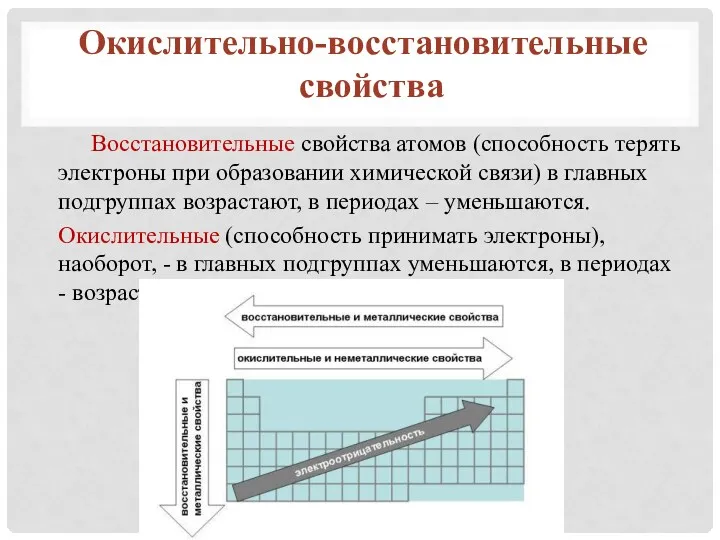
- 14. Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в главных подгруппах возрастают, в периодах
- 15. Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо. В группе
- 16. Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром электронных оболочек усиливается.
- 17. В одной и той же группе с увеличением номера периода атомные радиусы возрастают. Атомы металлов сравнительно
- 19. Скачать презентацию














 Промышленность Донбасса в ХIX веке
Промышленность Донбасса в ХIX веке Исходы беременностей у женщин с миомой матки
Исходы беременностей у женщин с миомой матки Повторение
Повторение Презентация Как ребята помогли Буратино домой вернуться!
Презентация Как ребята помогли Буратино домой вернуться! Влияние химических элементов на свойства сталей
Влияние химических элементов на свойства сталей Гормональная контрацепция. Медикаментозные аборты
Гормональная контрацепция. Медикаментозные аборты Развивающая среда
Развивающая среда Закупки. Дополнение к 1С:БГУ 8
Закупки. Дополнение к 1С:БГУ 8 Отношения объектов и их множеств
Отношения объектов и их множеств Транснациональные компании
Транснациональные компании Классный час по теме Конституция РФ
Классный час по теме Конституция РФ Культура и искусство Древней Греции
Культура и искусство Древней Греции Модель организации методической работы в муниципальном общеобразовательном учреждении Барашевская средняя общеобразовательная школа
Модель организации методической работы в муниципальном общеобразовательном учреждении Барашевская средняя общеобразовательная школа Влияние алкоголя на организм человека
Влияние алкоголя на организм человека Застывшая музыка
Застывшая музыка Игра 100 к 1
Игра 100 к 1 Нейроэндокринные опухоли поджелудочной железы
Нейроэндокринные опухоли поджелудочной железы Портфоліо. Мазурчук Олена Григорівна
Портфоліо. Мазурчук Олена Григорівна Дозирование жидких лекарственных форм
Дозирование жидких лекарственных форм Кодирование информации
Кодирование информации Сооружение опор выше обреза фундамента. Тема № 3
Сооружение опор выше обреза фундамента. Тема № 3 Рисующий свет
Рисующий свет Проверка электронного документа. Личный кабинет
Проверка электронного документа. Личный кабинет Методы и стили семейного воспитания
Методы и стили семейного воспитания Инструктаж по правилам дорожного движения (для детей)
Инструктаж по правилам дорожного движения (для детей) Соберём пазлы на тему:Масленица. 1 класс.
Соберём пазлы на тему:Масленица. 1 класс. Компьютерные презентации. Дизайн презентации и макеты слайдов
Компьютерные презентации. Дизайн презентации и макеты слайдов Творческий отчет заместителя директора по УР как показатель успешности деятельности образовательного учреждения 2013-2014 уч.год
Творческий отчет заместителя директора по УР как показатель успешности деятельности образовательного учреждения 2013-2014 уч.год