Содержание
- 2. Внутренняя энергия изолированной системы есть величина постоянная. ∆U = 0 Если в неизолированной системе протекает процесс,
- 3. При отсутствии немеханической работы: ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Тепловой эффект. Термохимия. QV = ∆U QP = ∆H Тепловым
- 4. Тепловой эффект процесса не зависит от промежуточных стадий, а определяется лишь начальным и конечным состояниями системы
- 5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Термохимия. H2 (г) + 0.5О2 (г) = Н2О (ж) ∆Н298 = -285,84 кДж/моль С6Н6
- 6. В общем виде уравнение химической реакции: v1A1 + v2A2 = v3A3 + v4A4 ∆rH0 ∆rH0 =
- 7. Второе следствие. Тепловой эффект разложения какого-либо химического соединения точно равен и противоположен по знаку тепловому эффекту
- 8. Четвертое следствие. Если совершается две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница
- 9. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Теплоемкость Теплоемкость – количество тепла Q, поглощаемое телом при нагревании на 1 градус
- 10. При постоянном объеме При постоянном давлении ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Теплоемкость δQV = dU δQP = dH
- 11. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Теплоемкость H = U+PV Для идеального газа: PV = RT
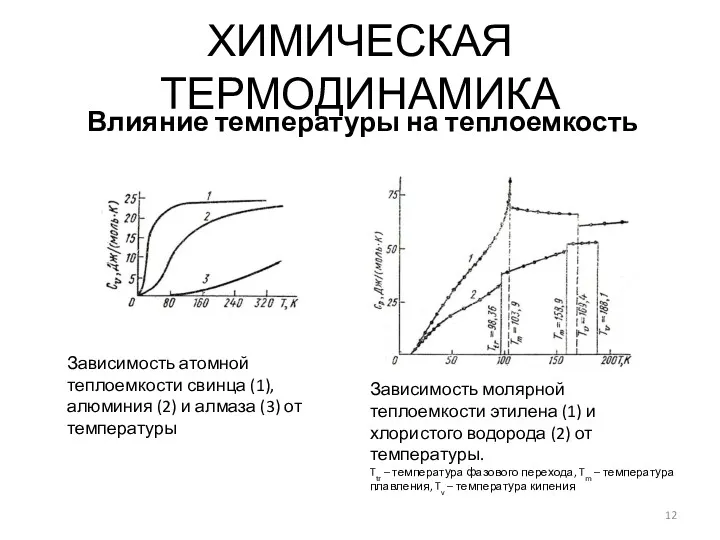
- 12. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Влияние температуры на теплоемкость Зависимость атомной теплоемкости свинца (1), алюминия (2) и алмаза (3)
- 13. CP = a + bT + cT2 для органических соединений CP = a + bT +
- 14. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа В общем виде уравнение химической реакции: v1A1 + v2A2
- 15. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Зависимость теплового эффекта от температуры. Уравнение Кирхгофа Выведено Кирхгофом в 1858г. Густав Роберт Кирхгоф,
- 16. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- 17. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Зависимость теплового эффекта от температуры. Уравнение Кирхгофа При интегрировании
- 18. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Расчет теплового эффекта по температурным рядам теплоемкости CP = a + bT + c*T-2
- 19. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Расчет теплового эффекта по высокотемпературным составляющим энтальпии
- 20. Все процессы в природе можно разделить на самопроизвольные и несамопроизвольные. В изолированной системе без внешнего воздействия
- 21. В 1752 г. Ломоносов сформулировал постулат о невозможности перехода тепла от холодного тела к теплому. В
- 22. Кельвин (1881г.) и Планк (1891г.): Невозможна периодически действующая тепловая машина, единственным результатом действия которой было бы
- 23. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Энтропия Для бесконечно малого квазистатического процесса
- 24. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Энтропия Если интеграл, взятый по замкнутому контуру, равен нулю, то существует функция состояния, полный
- 25. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Энтропия
- 26. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Изменение энтропии как критерий направленности и равновесия в изолированной системе При квазистатическом процессе в
- 27. Закон применим только для макроскопических систем. Не может быть примененным ко всей вселенной в целом. Изменение
- 28. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА Изменение энтропии в различных процессах Процессы нагрева и охлаждения
- 29. Термодинамические потенциалы Энергия Гиббса Изобарно-изотермический потенциал При Т, P = const
- 30. Термодинамические потенциалы Энергия Гельмгольца Изохоно-изотермический потенциал При Т, V = const
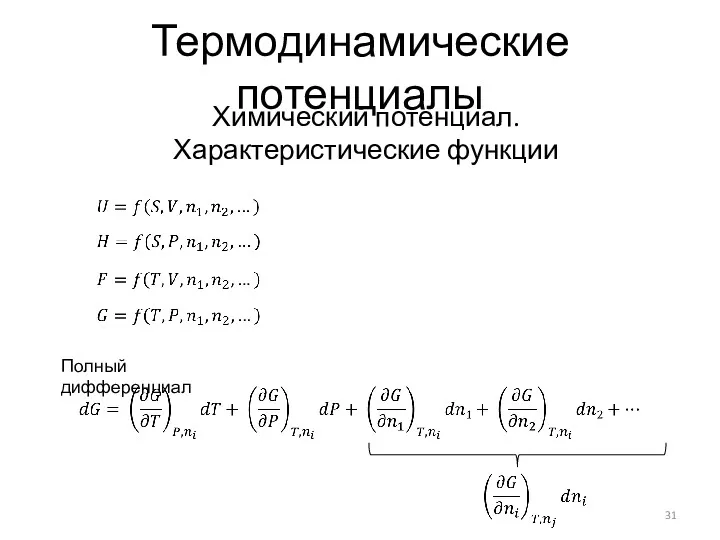
- 31. Термодинамические потенциалы Химический потенциал. Характеристические функции Полный дифференциал
- 32. Термодинамические потенциалы Химический потенциал. Характеристические функции Химический потенциал, мера реакционной способности вещества Ввел в 1875г. Гиббс
- 33. Термодинамические потенциалы Химический потенциал. Характеристические функции часть изменения энергии системы, которая связана непосредственно с изменением природы
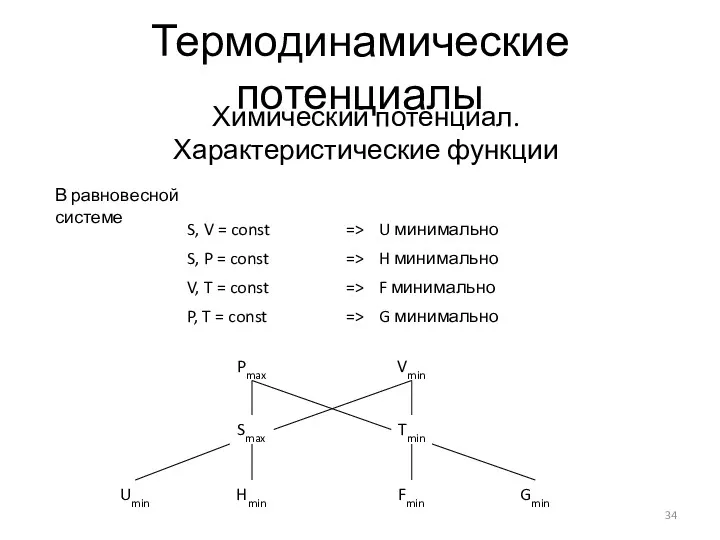
- 34. Термодинамические потенциалы Химический потенциал. Характеристические функции В равновесной системе Pmax Vmin Smax Tmin Hmin Umin Fmin
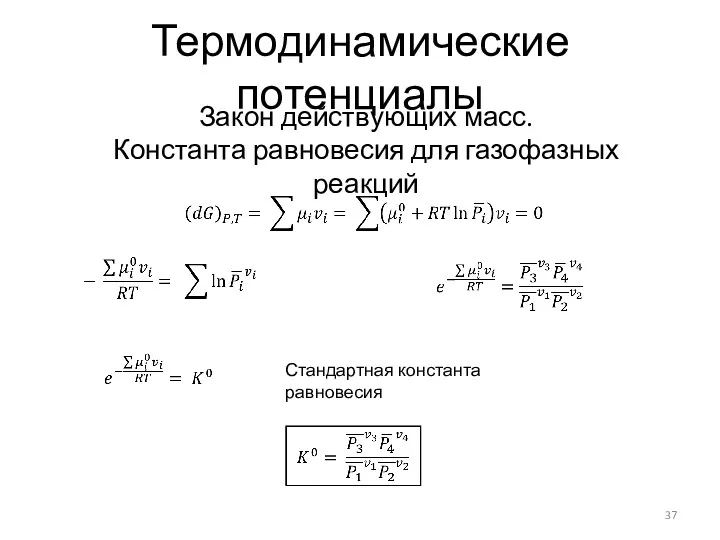
- 35. Термодинамические потенциалы Закон действующих масс. Константа равновесия для газофазных реакций v1A1 + v2A2 v3A3 + v4A4
- 36. Термодинамические потенциалы Закон действующих масс. Константа равновесия для газофазных реакций Состояние химического равновесия определяется: Если система
- 37. Термодинамические потенциалы Закон действующих масс. Константа равновесия для газофазных реакций Стандартная константа равновесия
- 38. Термодинамическое равновесие Закон действующих масс. Константа равновесия для газофазных реакций
- 39. Термодинамическое равновесие Уравнение изотермы реакции Относительные парциальные давления реагентов
- 40. Уравнение изотермы реакции Уравнение изотермы Вант-Гоффа, сформулировано в 1886г Термодинамическое равновесие
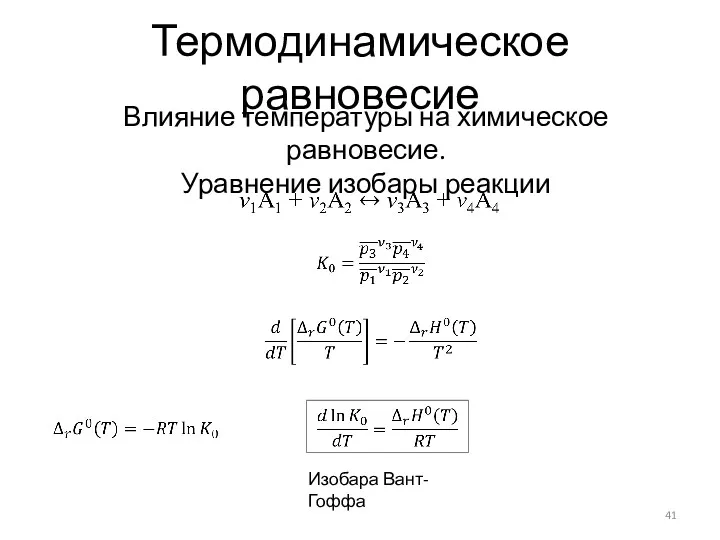
- 41. Термодинамическое равновесие Влияние температуры на химическое равновесие. Уравнение изобары реакции Изобара Вант-Гоффа
- 43. Скачать презентацию



































 Процессор. История одного устройства
Процессор. История одного устройства Ионизирующие излучения, нормирование, защита. источники,
Ионизирующие излучения, нормирование, защита. источники, Театрализация русской народной сказки
Театрализация русской народной сказки Обществознание, как наука о человеке и существовании в обществе
Обществознание, как наука о человеке и существовании в обществе Economic Phoenix. Of Industrial Hemp
Economic Phoenix. Of Industrial Hemp Жер жұмысы құрылымдары және құрылыс негіздеры
Жер жұмысы құрылымдары және құрылыс негіздеры Методологические основы научной деятельности. Исследовательский инструментарий
Методологические основы научной деятельности. Исследовательский инструментарий План рисков бизнес-плана
План рисков бизнес-плана Физико-географическое положение и история открытия Южной Америки
Физико-географическое положение и история открытия Южной Америки Архитектура персонального компьютера
Архитектура персонального компьютера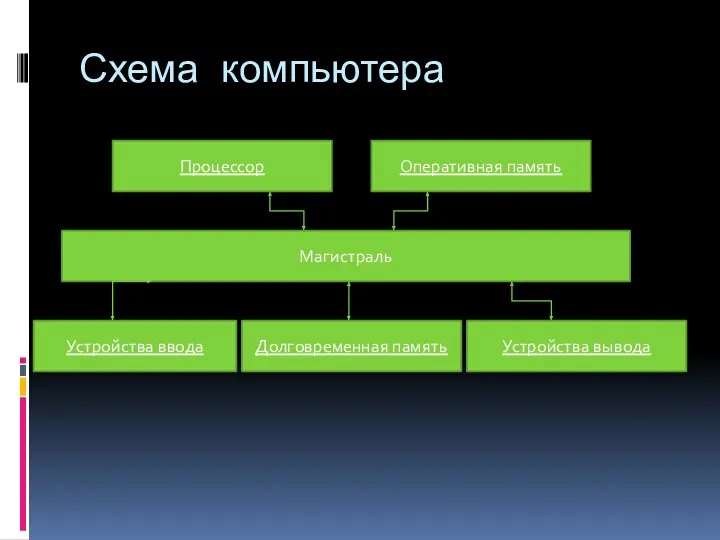 Схема компьютера
Схема компьютера Правила поведения велосипедиста. Памятка
Правила поведения велосипедиста. Памятка Классный час Вместе по планете
Классный час Вместе по планете Стеклянные бытовые товары
Стеклянные бытовые товары Компьютер для ребенка - хорошо или плохо
Компьютер для ребенка - хорошо или плохо Конфуцианство. Жизнь Конфуция и его учения
Конфуцианство. Жизнь Конфуция и его учения Без кота и жизнь не та
Без кота и жизнь не та Презентация к педсовету.
Презентация к педсовету. Информационные связи в системах различной природы
Информационные связи в системах различной природы Выбор автотранспортного средства для перевозки цемента в биг-бегах при организации транспортно-логистической деятельности
Выбор автотранспортного средства для перевозки цемента в биг-бегах при организации транспортно-логистической деятельности Решение тригонометрических уравнений. Повторим значения синуса и косинуса
Решение тригонометрических уравнений. Повторим значения синуса и косинуса EvroPlast. Примеры готовых бутылок из преформы 65 гр. 38 мм Bericap
EvroPlast. Примеры готовых бутылок из преформы 65 гр. 38 мм Bericap Я выполняю проект. Рекомендации детям и взрослым
Я выполняю проект. Рекомендации детям и взрослым Числовые промежутки. 8 класс
Числовые промежутки. 8 класс Франко Альбини (1905-1977) — итальянский архитектор и дизайнер рационалистического направления
Франко Альбини (1905-1977) — итальянский архитектор и дизайнер рационалистического направления Презентация Интеллектуальное развитие в играх
Презентация Интеллектуальное развитие в играх MSC. Sustainability at MSC 2022
MSC. Sustainability at MSC 2022 Идентификация и фальсификация отдельных групп продовольственных товаров
Идентификация и фальсификация отдельных групп продовольственных товаров