Содержание
- 2. Пресинаптические механизмы обеспечивают модуляцию экзоцитоза медиатора из пресинаптического волокна, в основе которой лежат следующие процессы: 1)
- 3. Постсинаптические механизмы также включают разнообразные процессы: 1) изменение чувствительности рецепторов постсинаптической мембраны к медиатору в результате
- 4. Постсинаптические механизмы (продолжение) также включают разнообразные процессы: 4) синаптические контакты структурно поддерживаются молекулами клеточной адгезии пре-
- 5. Две формы синаптической пластичности Гомосинаптическая пластичность заключается в изменениях эффективности синаптической передачи, которые обусловлены предшествующими событиями
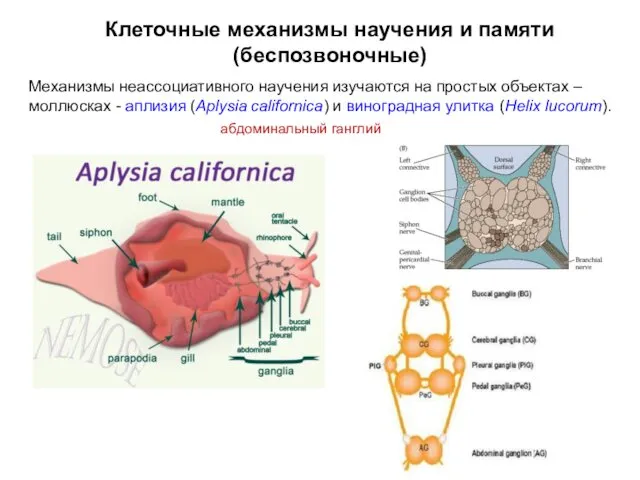
- 6. Механизмы неассоциативного научения изучаются на простых объектах – моллюсках - аплизия (Aplysia californica) и виноградная улитка
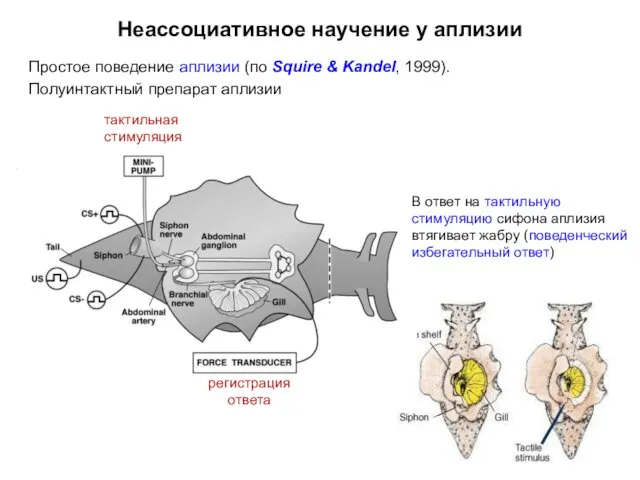
- 7. Неассоциативное научение у аплизии Простое поведение аплизии (по Squire & Kandel, 1999). Полуинтактный препарат аплизии тактильная
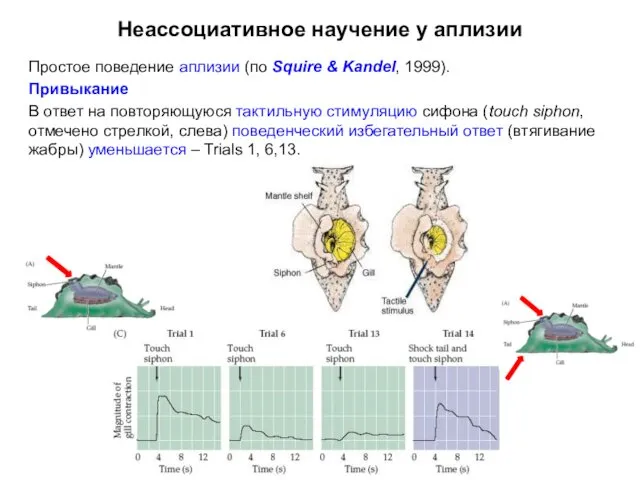
- 8. Неассоциативное научение у аплизии Простое поведение аплизии (по Squire & Kandel, 1999). Привыкание В ответ на
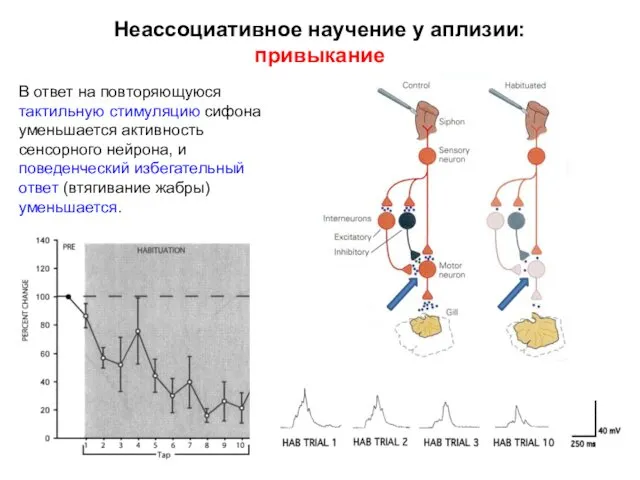
- 9. Неассоциативное научение у аплизии: привыкание В ответ на повторяющуюся тактильную стимуляцию сифона уменьшается активность сенсорного нейрона,
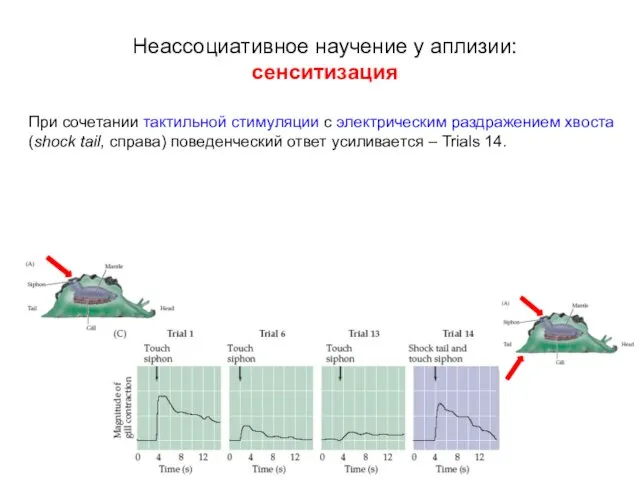
- 10. Неассоциативное научение у аплизии: сенситизация При сочетании тактильной стимуляции с электрическим раздражением хвоста (shock tail, справа)
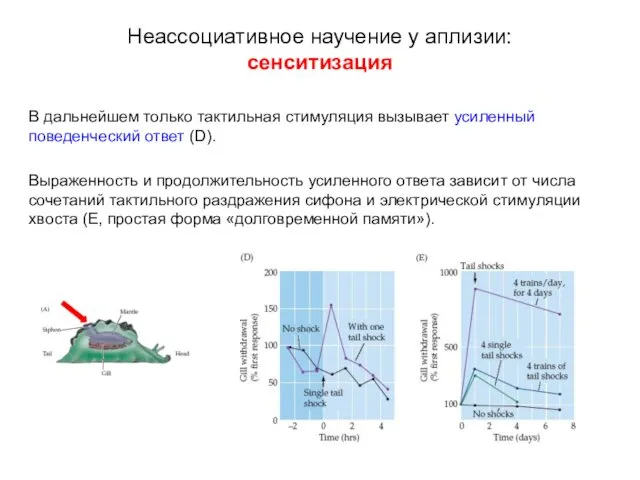
- 11. В дальнейшем только тактильная стимуляция вызывает усиленный поведенческий ответ (D). Выраженность и продолжительность усиленного ответа зависит
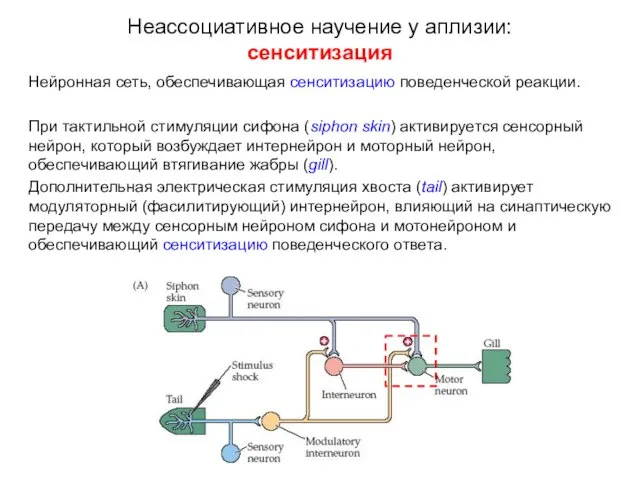
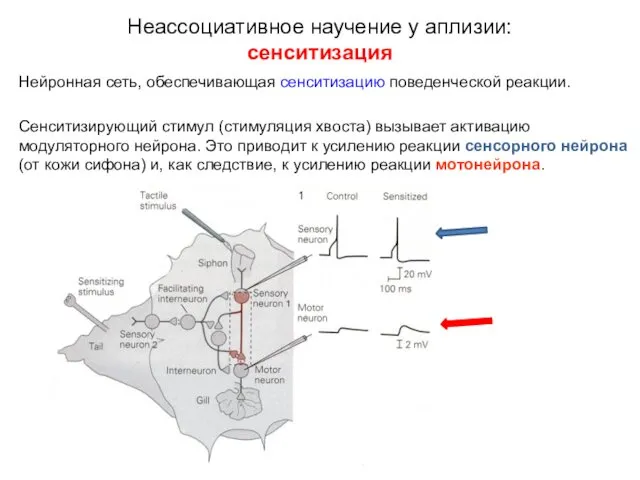
- 12. Нейронная сеть, обеспечивающая сенситизацию поведенческой реакции. При тактильной стимуляции сифона (siphon skin) активируется сенсорный нейрон, который
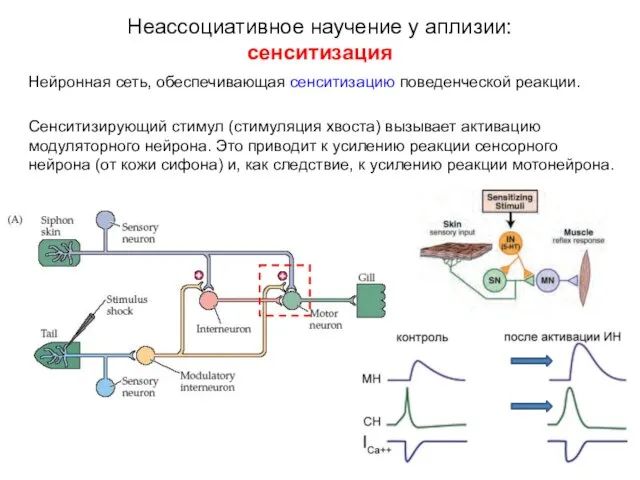
- 13. Нейронная сеть, обеспечивающая сенситизацию поведенческой реакции. Сенситизирующий стимул (стимуляция хвоста) вызывает активацию модуляторного нейрона. Это приводит
- 14. Нейронная сеть, обеспечивающая сенситизацию поведенческой реакции. Сенситизирующий стимул (стимуляция хвоста) вызывает активацию модуляторного нейрона. Это приводит
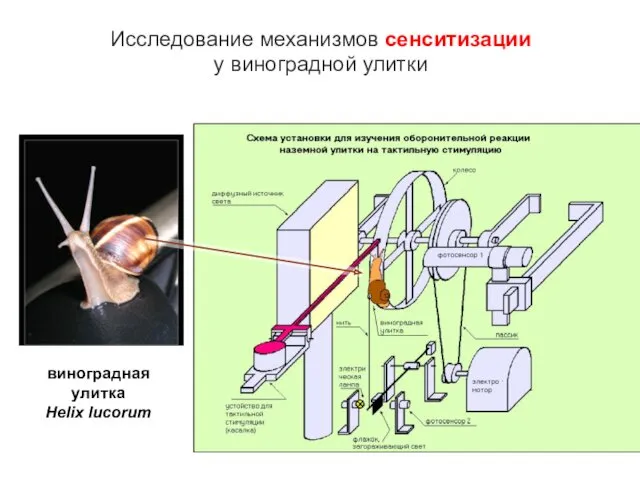
- 15. Исследование механизмов сенситизации у виноградной улитки виноградная улитка Helix lucorum
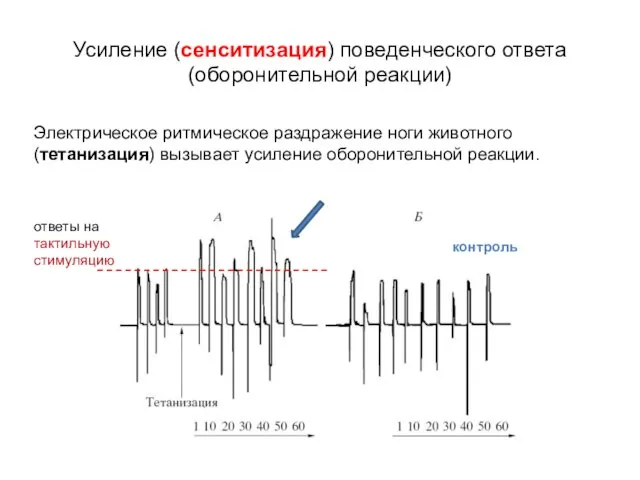
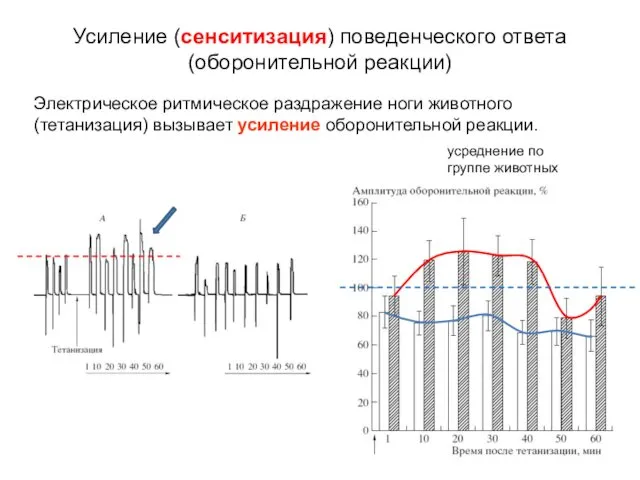
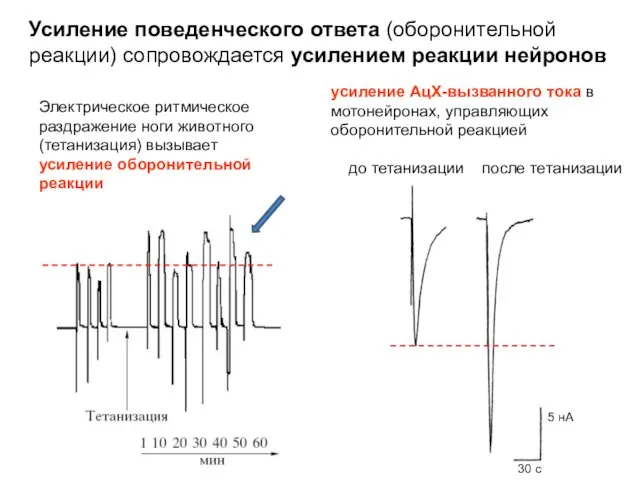
- 16. Электрическое ритмическое раздражение ноги животного (тетанизация) вызывает усиление оборонительной реакции. Усиление (сенситизация) поведенческого ответа (оборонительной реакции)
- 17. Электрическое ритмическое раздражение ноги животного (тетанизация) вызывает усиление оборонительной реакции. Усиление (сенситизация) поведенческого ответа (оборонительной реакции)
- 18. Электрическое ритмическое раздражение ноги животного (тетанизация) вызывает усиление оборонительной реакции усиление АцХ-вызванного тока в мотонейронах, управляющих
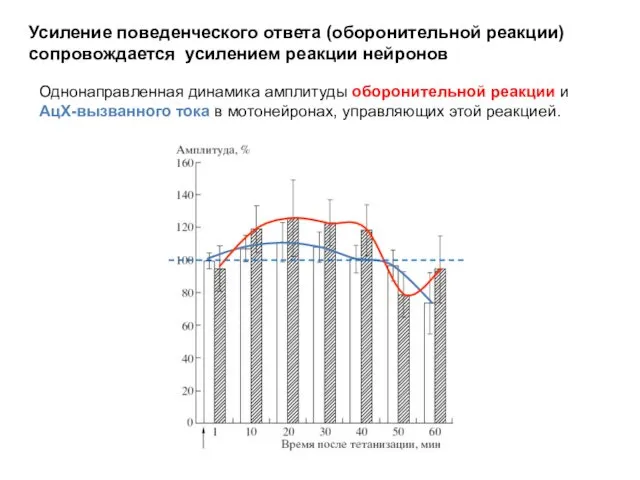
- 19. Однонаправленная динамика амплитуды оборонительной реакции и АцХ-вызванного тока в мотонейронах, управляющих этой реакцией. Усиление поведенческого ответа
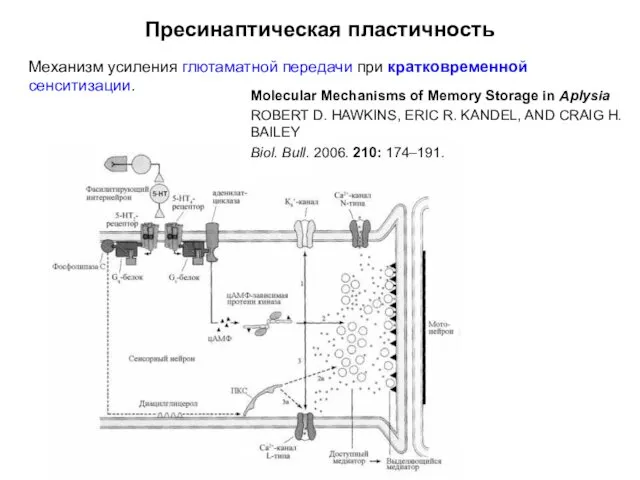
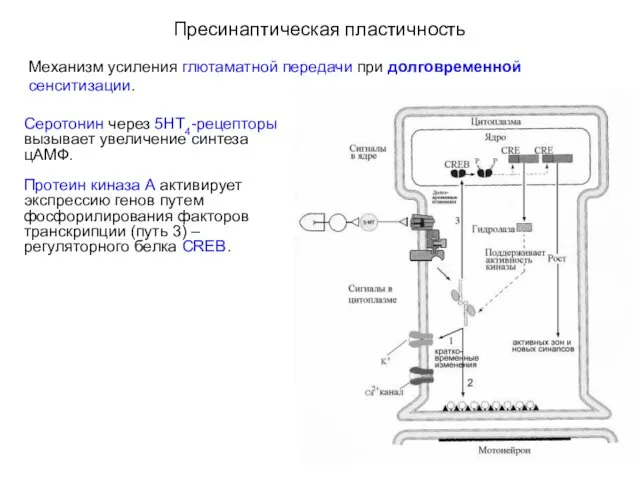
- 20. Пресинаптическая пластичность Механизм усиления глютаматной передачи при кратковременной сенситизации. Molecular Mechanisms of Memory Storage in Aplysia
- 21. Пресинаптическая пластичность Механизм усиления глютаматной передачи при кратковременной сенситизации. Серотонин через 5НТ4-рецепторы инициирует каскады синтеза цАМФ,
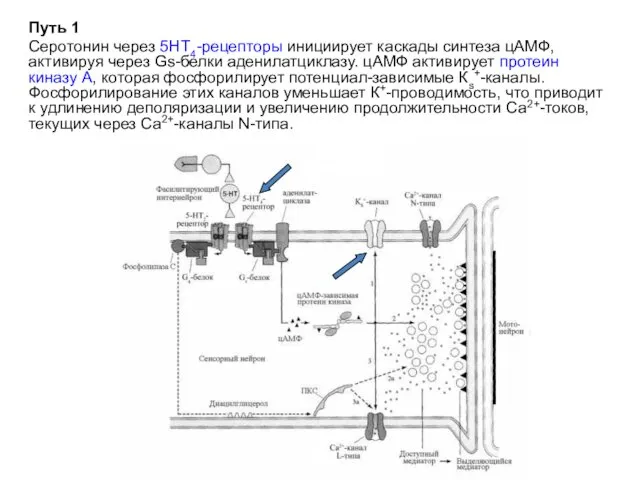
- 22. Путь 1 Серотонин через 5НТ4-рецепторы инициирует каскады синтеза цАМФ, активируя через Gs-белки аденилатциклазу. цАМФ активирует протеин
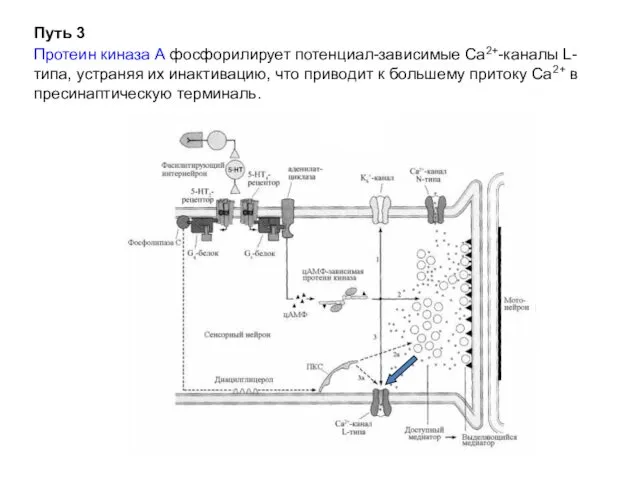
- 23. Путь 3 Протеин киназа А фосфорилирует потенциал-зависимые Са2+-каналы L-типа, устраняя их инактивацию, что приводит к большему
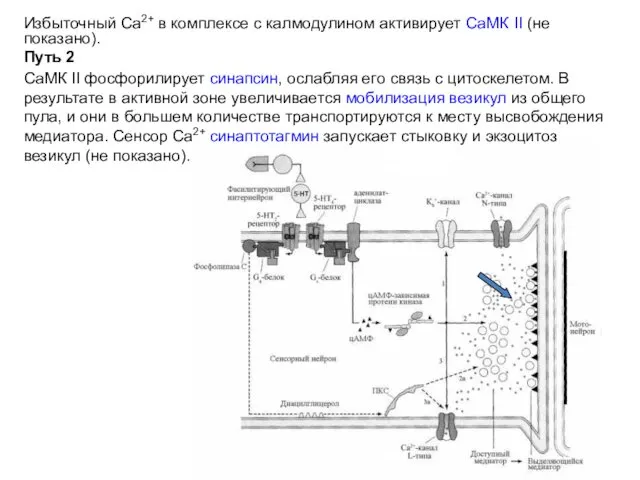
- 24. Избыточный Са2+ в комплексе с калмодулином активирует СаМК II (не показано). Путь 2 СаМК II фосфорилирует
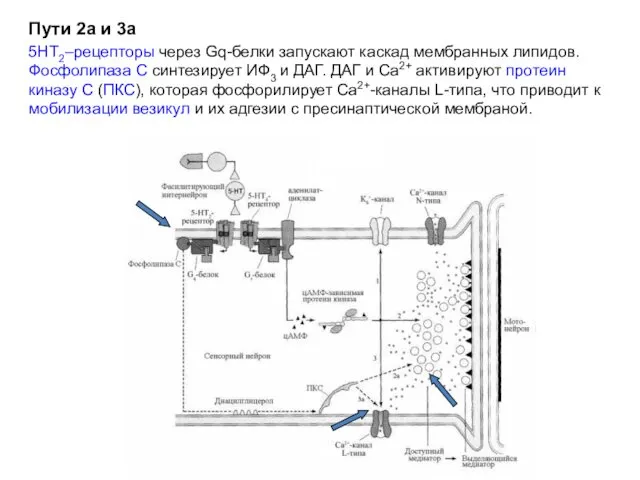
- 25. Пути 2а и 3а 5НТ2–рецепторы через Gq-белки запускают каскад мембранных липидов. Фосфолипаза С синтезирует ИФ3 и
- 26. Пресинаптическая пластичность Механизм усиления глютаматной передачи при долговременной сенситизации. Серотонин через 5НТ4-рецепторы вызывает увеличение синтеза цАМФ.
- 27. Пресинаптическая пластичность Механизм усиления глютаматной передачи при долговременной сенситизации. Серотонин через 5НТ4-рецепторы вызывает увеличение синтеза цАМФ.
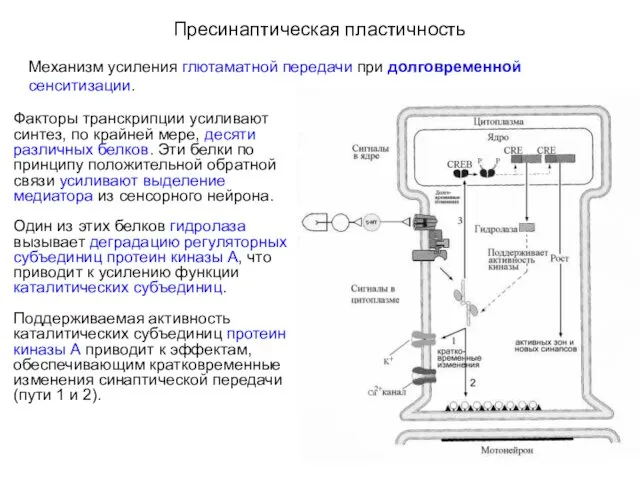
- 28. Пресинаптическая пластичность Механизм усиления глютаматной передачи при долговременной сенситизации. Факторы транскрипции усиливают синтез, по крайней мере,
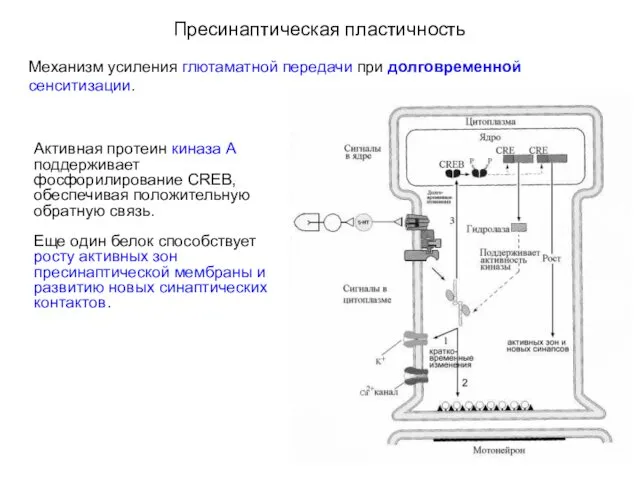
- 29. Пресинаптическая пластичность Механизм усиления глютаматной передачи при долговременной сенситизации. Активная протеин киназа А поддерживает фосфорилирование CREB,
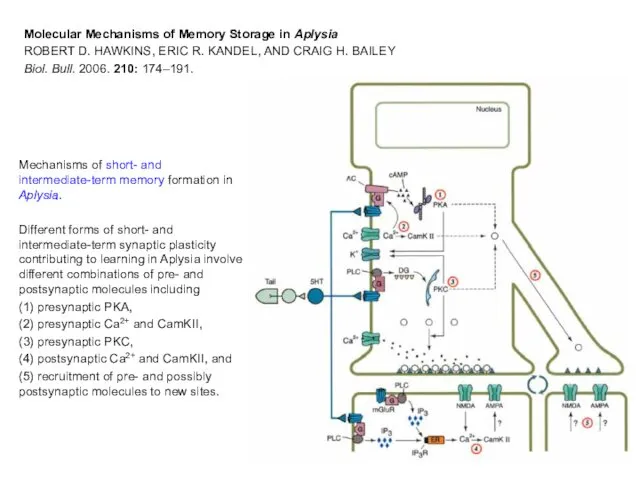
- 30. Mechanisms of short- and intermediate-term memory formation in Aplysia. Different forms of short- and intermediate-term synaptic
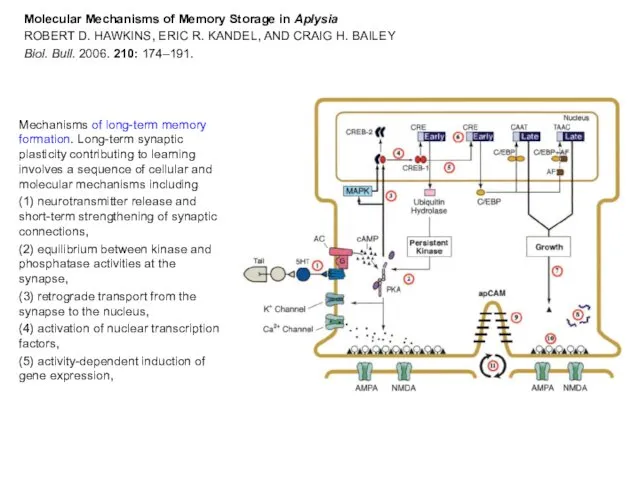
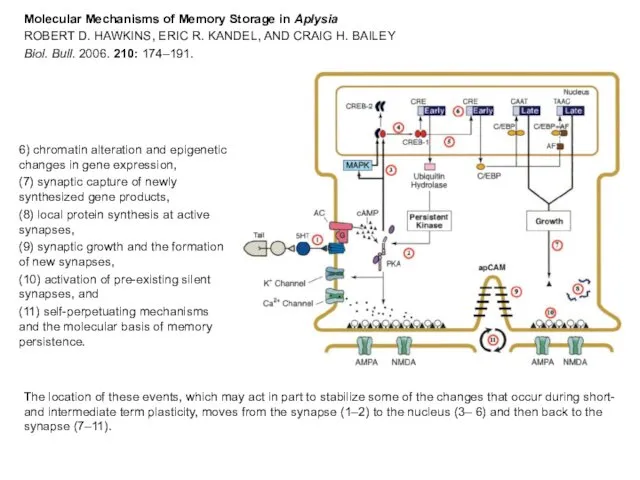
- 31. Molecular Mechanisms of Memory Storage in Aplysia ROBERT D. HAWKINS, ERIC R. KANDEL, AND CRAIG H.
- 32. The location of these events, which may act in part to stabilize some of the changes
- 33. Постсинаптическая пластичность Примером постсинаптической пластичности является долговременная потенциация (ДВП). Феномен ДВП заключается в продолжительном усилении постсинаптического
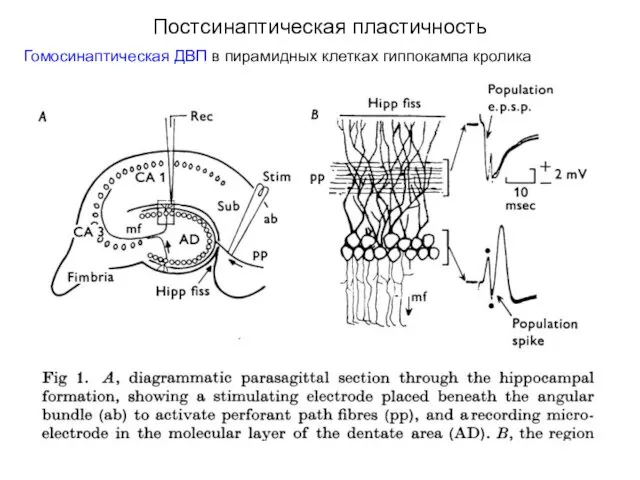
- 34. Постсинаптическая пластичность Гомосинаптическая ДВП в пирамидных клетках гиппокампа кролика
- 35. Постсинаптическая пластичность Гомосинаптическая ДВП в пирамидных клетках гиппокампа кролика
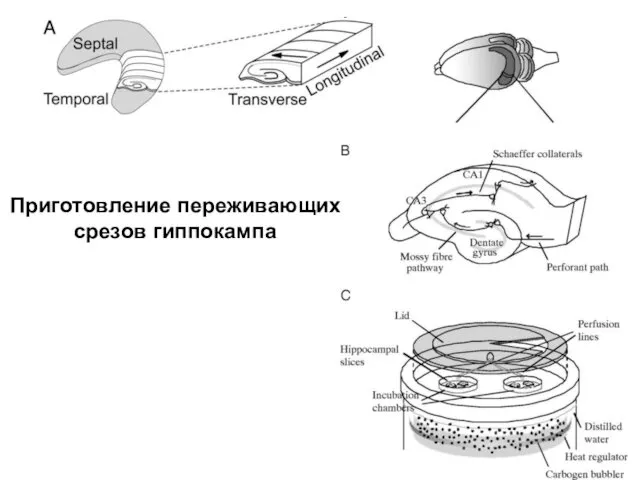
- 36. Приготовление переживающих срезов гиппокампа
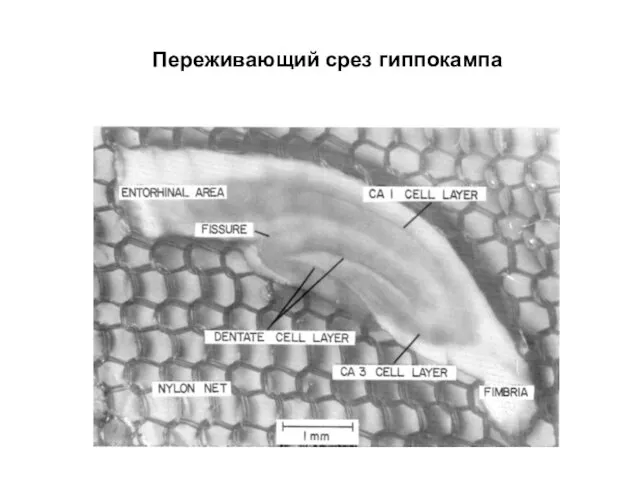
- 37. Переживающий срез гиппокампа
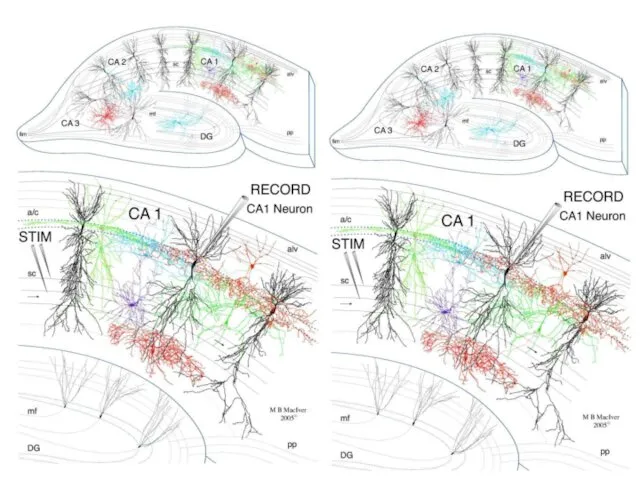
- 38. Установка для регистрации потенциалов от переживающих срезов гиппокампа
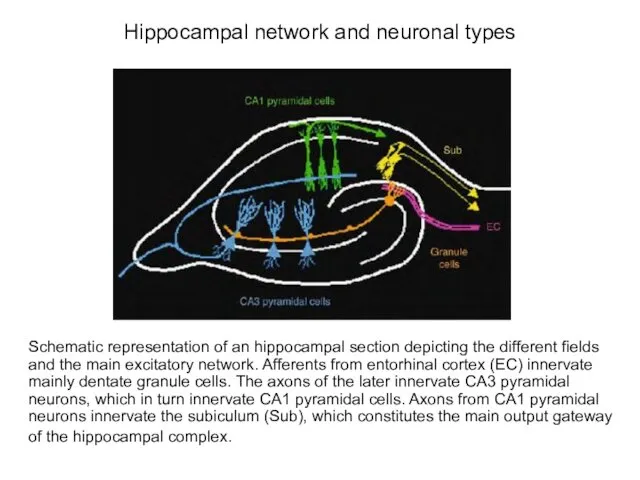
- 39. Hippocampal network and neuronal types Schematic representation of an hippocampal section depicting the different fields and
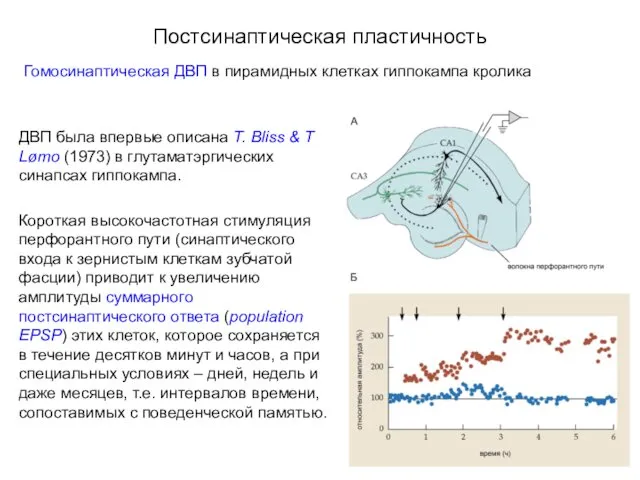
- 40. Постсинаптическая пластичность Гомосинаптическая ДВП в пирамидных клетках гиппокампа кролика ДВП была впервые описана T. Bliss &
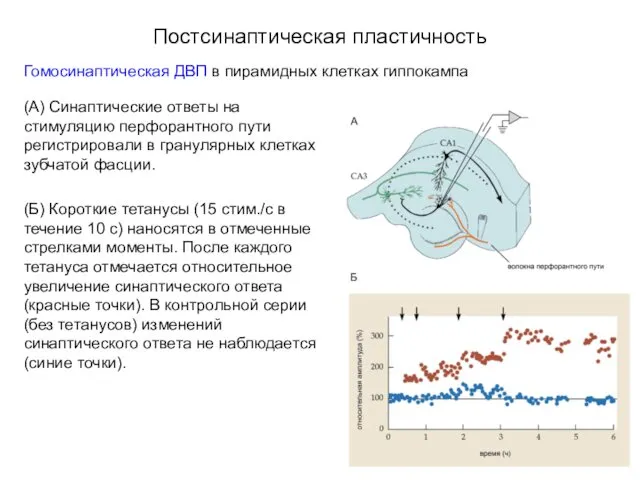
- 41. Постсинаптическая пластичность Гомосинаптическая ДВП в пирамидных клетках гиппокампа (А) Синаптические ответы на стимуляцию перфорантного пути регистрировали
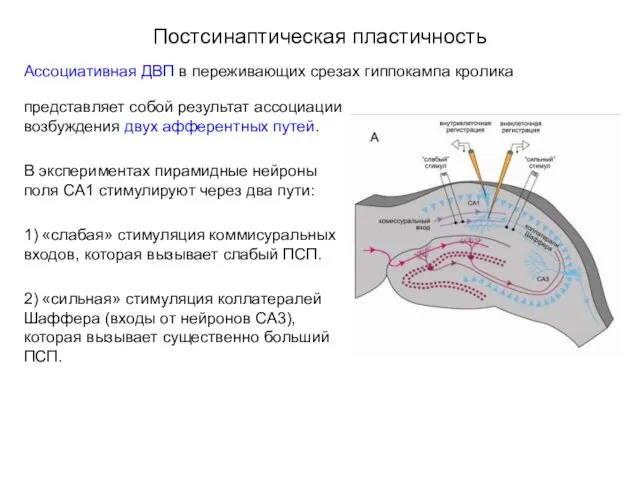
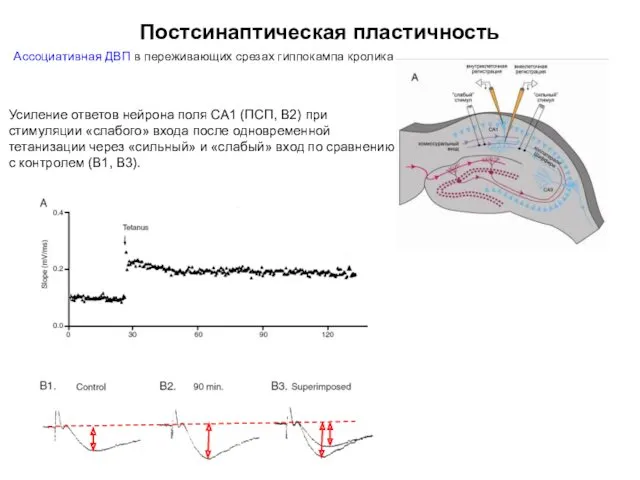
- 42. Постсинаптическая пластичность Ассоциативная ДВП в переживающих срезах гиппокампа кролика представляет собой результат ассоциации возбуждения двух афферентных
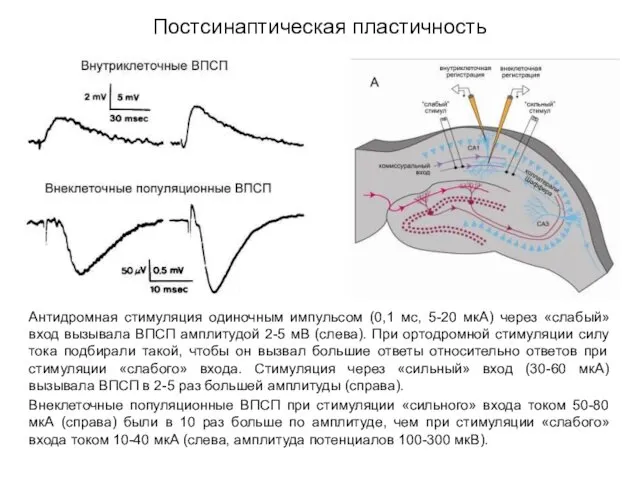
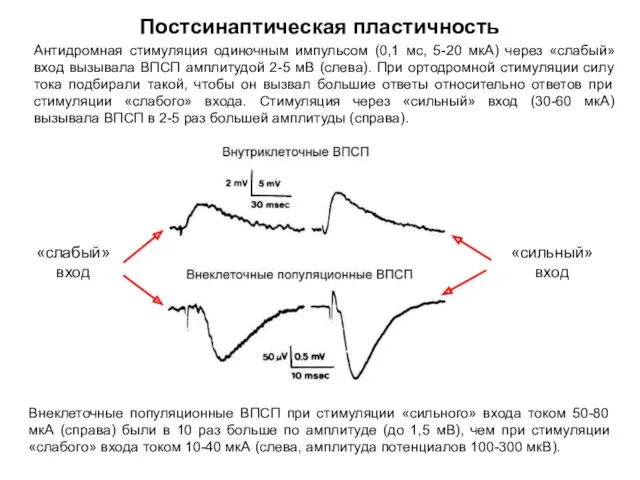
- 44. Постсинаптическая пластичность Антидромная стимуляция одиночным импульсом (0,1 мс, 5-20 мкА) через «слабый» вход вызывала ВПСП амплитудой
- 45. Постсинаптическая пластичность Антидромная стимуляция одиночным импульсом (0,1 мс, 5-20 мкА) через «слабый» вход вызывала ВПСП амплитудой
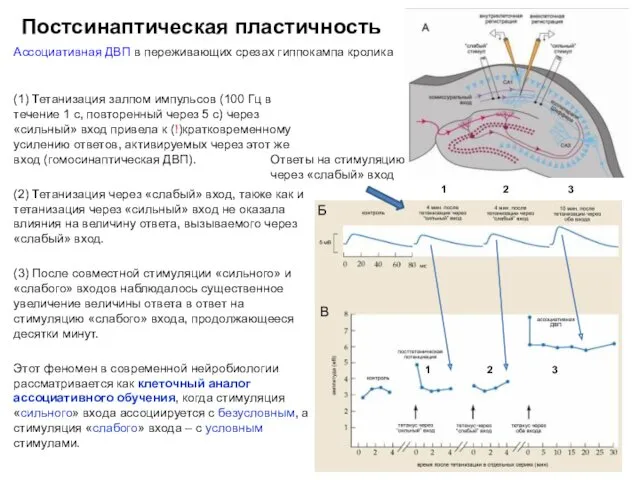
- 46. Постсинаптическая пластичность Ассоциативная ДВП в переживающих срезах гиппокампа кролика (1) Тетанизация залпом импульсов (100 Гц в
- 47. Постсинаптическая пластичность Ассоциативная ДВП в переживающих срезах гиппокампа кролика Усиление ответов нейрона поля СА1 (ПСП, В2)
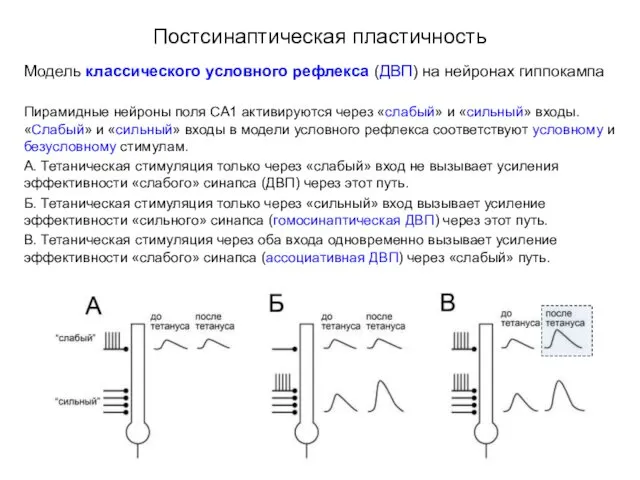
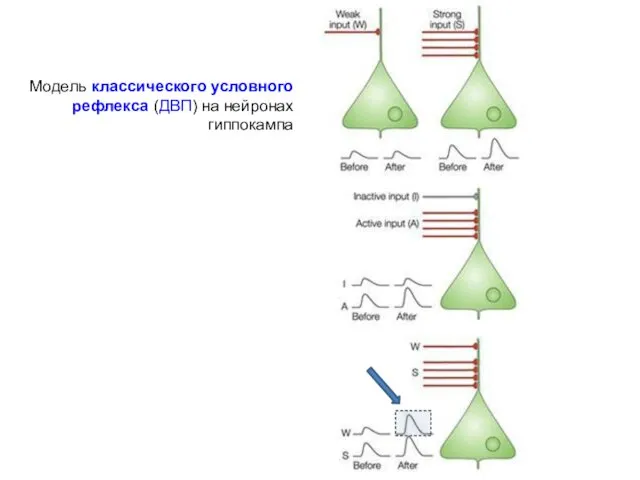
- 48. Постсинаптическая пластичность Модель классического условного рефлекса (ДВП) на нейронах гиппокампа Пирамидные нейроны поля СА1 активируются через
- 49. Модель классического условного рефлекса (ДВП) на нейронах гиппокампа
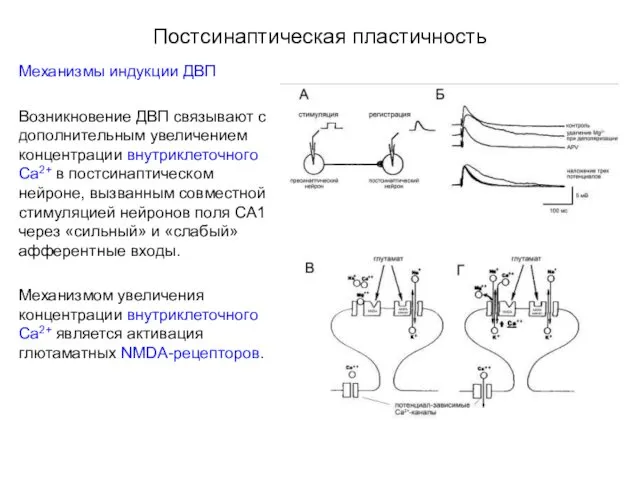
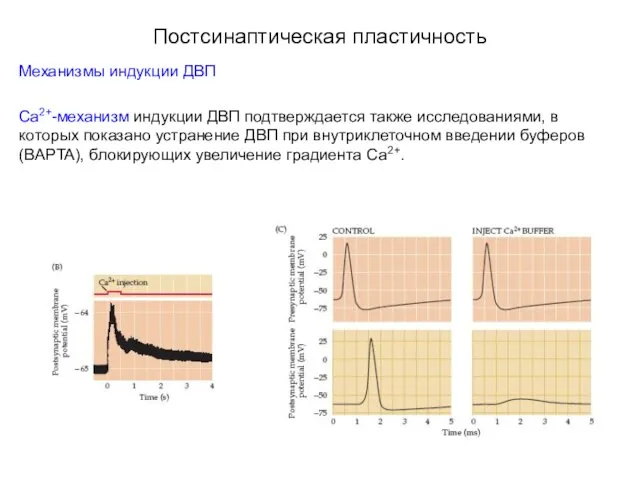
- 50. Постсинаптическая пластичность Механизмы индукции ДВП Возникновение ДВП связывают с дополнительным увеличением концентрации внутриклеточного Са2+ в постсинаптическом
- 51. Постсинаптическая пластичность Механизмы индукции ДВП Са2+-механизм индукции ДВП подтверждается также исследованиями, в которых показано устранение ДВП
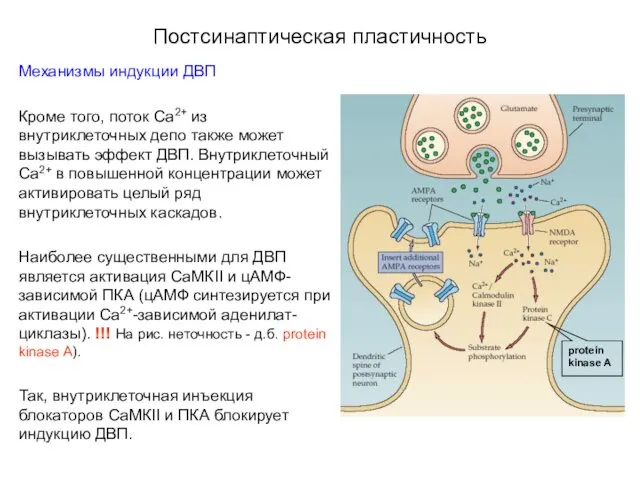
- 52. Постсинаптическая пластичность Механизмы индукции ДВП Кроме того, поток Са2+ из внутриклеточных депо также может вызывать эффект
- 53. Постсинаптическая пластичность Молекулярные механизмы ДВП Выделяют три механизма: 1) Регуляция количества синаптических рецепторов 2) Синтез новых
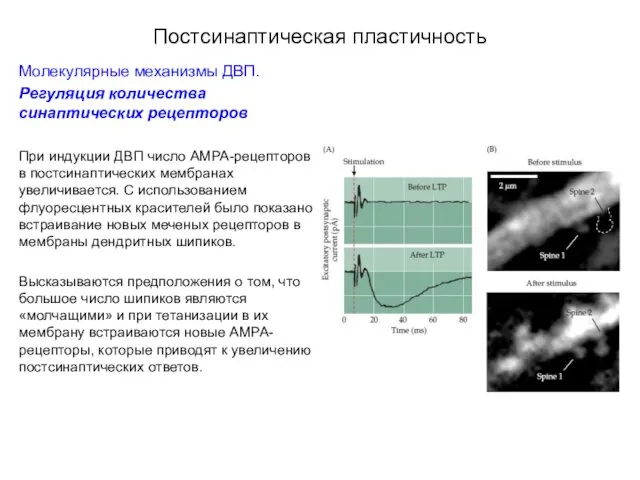
- 54. Постсинаптическая пластичность Молекулярные механизмы ДВП. Регуляция количества синаптических рецепторов При индукции ДВП число АМРА-рецепторов в постсинаптических
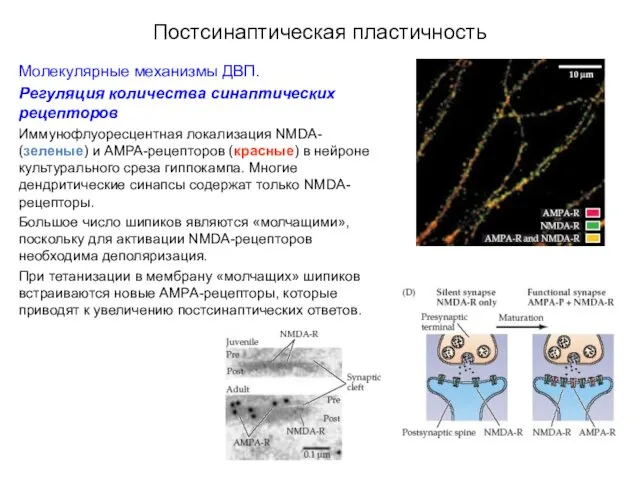
- 55. Постсинаптическая пластичность Молекулярные механизмы ДВП. Регуляция количества синаптических рецепторов Иммунофлуоресцентная локализация NMDA- (зеленые) и AMPA-рецепторов (красные)
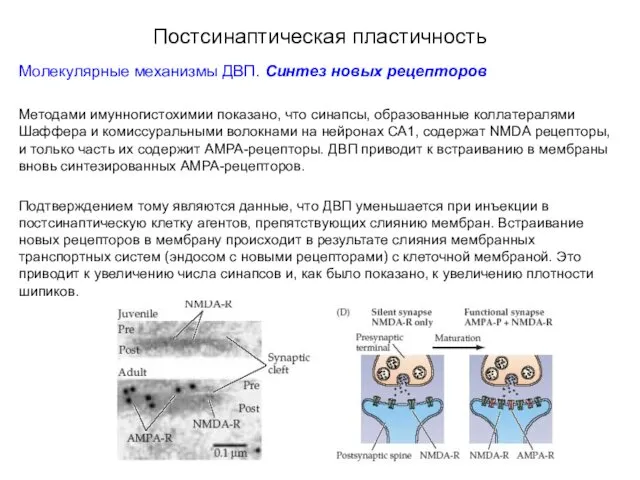
- 56. Постсинаптическая пластичность Молекулярные механизмы ДВП. Синтез новых рецепторов Методами имунногистохимии показано, что синапсы, образованные коллатералями Шаффера
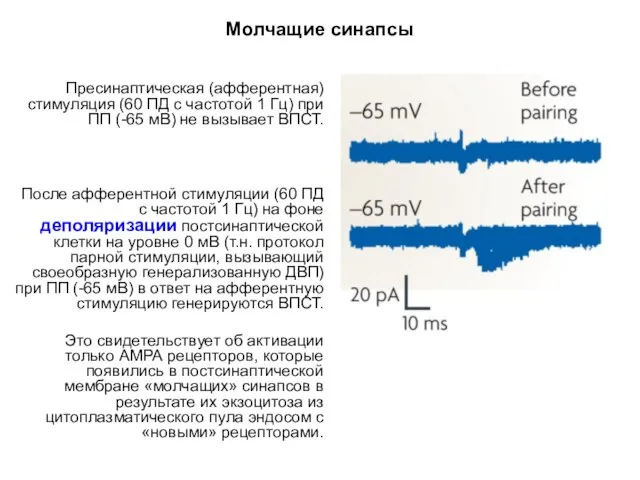
- 57. Молчащие синапсы «Молчащий» синапс не генерирует ВПСТ в ответ на его афферентную активацию при ПП, но
- 58. Молчащие синапсы Пресинаптическая (афферентная) стимуляция (60 ПД с частотой 1 Гц) при ПП (-65 мВ) не
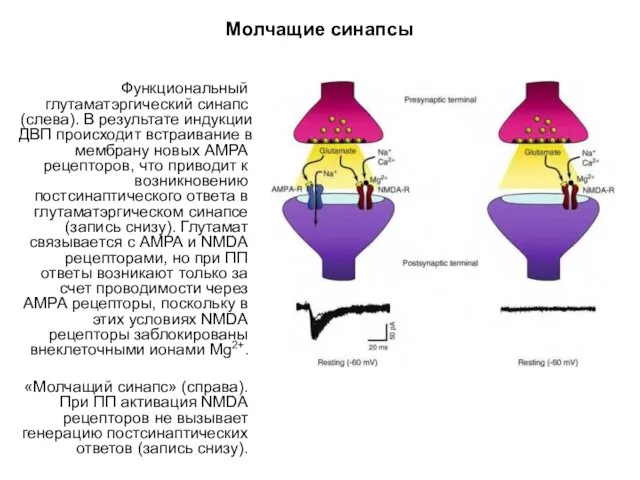
- 59. Молчащие синапсы Функциональный глутаматэргический синапс (слева). В результате индукции ДВП происходит встраивание в мембрану новых АМРА
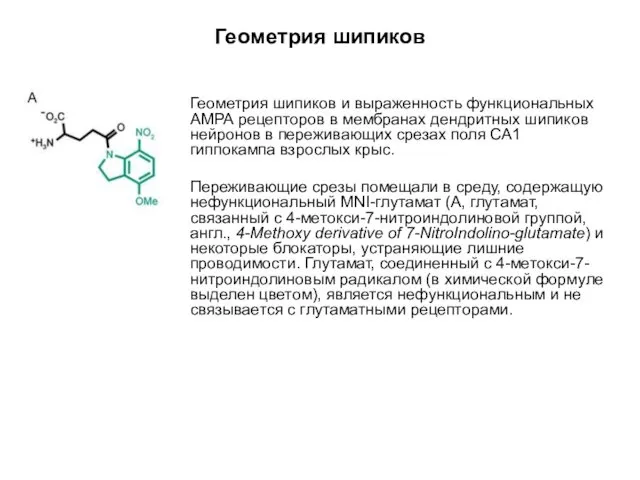
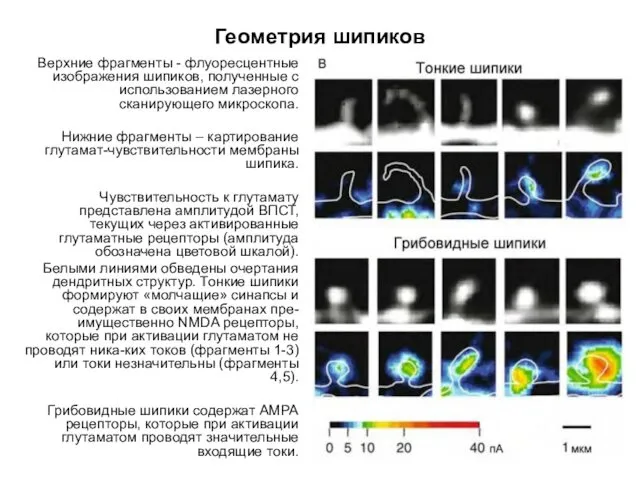
- 60. Геометрия шипиков Геометрия шипиков и выраженность функциональных АМРА рецепторов в мембранах дендритных шипиков нейронов в переживающих
- 61. Геометрия шипиков Геометрия шипиков и выраженность функциональных АМРА рецепторов в мембранах дендритных шипиков нейронов в переживающих
- 62. Геометрия шипиков а. Трехмерная реконструкция фрагмента дендрита с шипиками, полученная методом флуоресцентной сканирующей лазерной микроскопии. б.
- 63. Геометрия шипиков Верхние фрагменты - флуоресцентные изображения шипиков, полученные с использованием лазерного сканирующего микроскопа. Нижние фрагменты
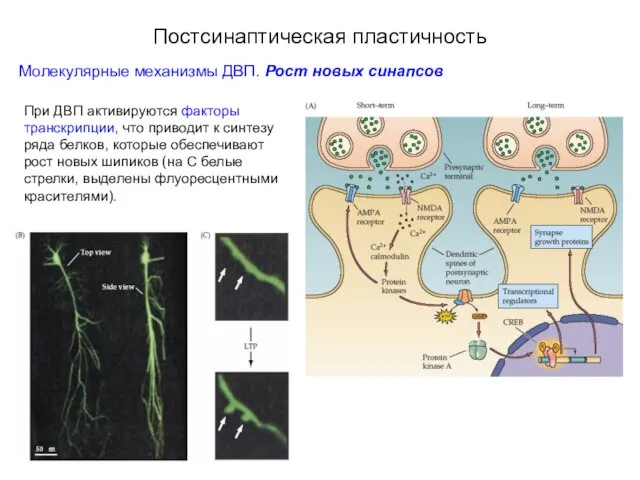
- 64. Постсинаптическая пластичность Молекулярные механизмы ДВП. Рост новых синапсов При ДВП активируются факторы транскрипции, что приводит к
- 65. Постсинаптическая пластичность Молекулярные механизмы ДВП. Роль Са2+ Высокая деполяризация после тетанизации в постсинаптических нейронах приводит к
- 66. Постсинаптическая пластичность Молекулярные механизмы ДВП. Роль Са2+ Относительно кратковременные изменения синаптической пластичности (до 3 ч) происходят
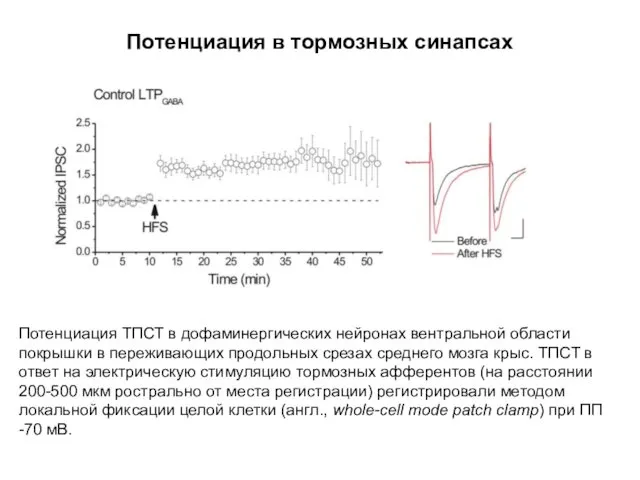
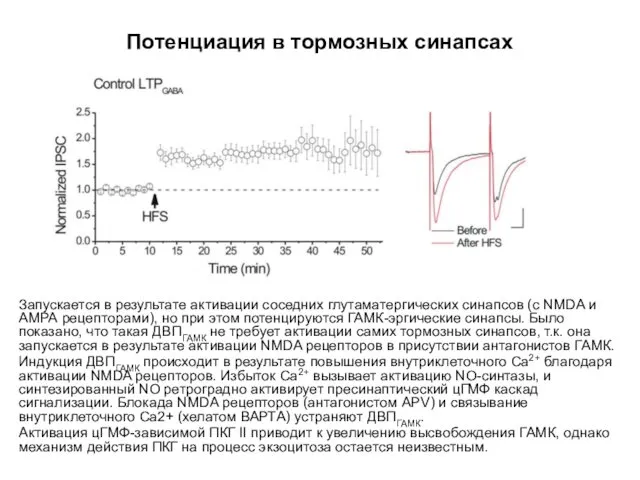
- 67. Потенциация в тормозных синапсах Потенциация ТПСТ в дофаминергических нейронах вентральной области покрышки в переживающих продольных срезах
- 68. Потенциация в тормозных синапсах Запускается в результате активации соседних глутаматергических синапсов (с NMDA и АМРА рецепторами),
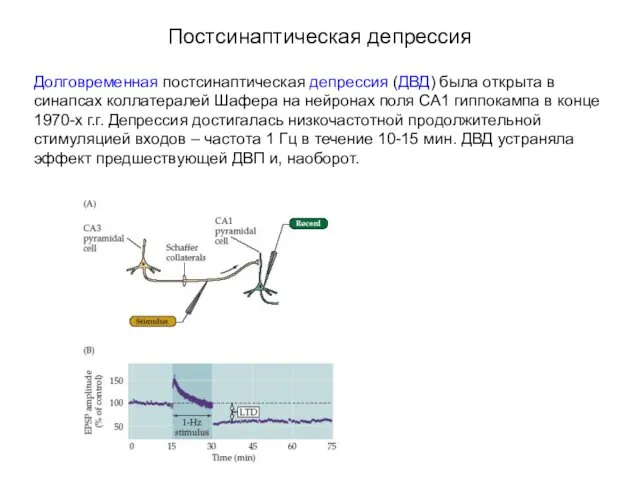
- 69. Постсинаптическая депрессия Долговременная постсинаптическая депрессия (ДВД) была открыта в синапсах коллатералей Шафера на нейронах поля СА1
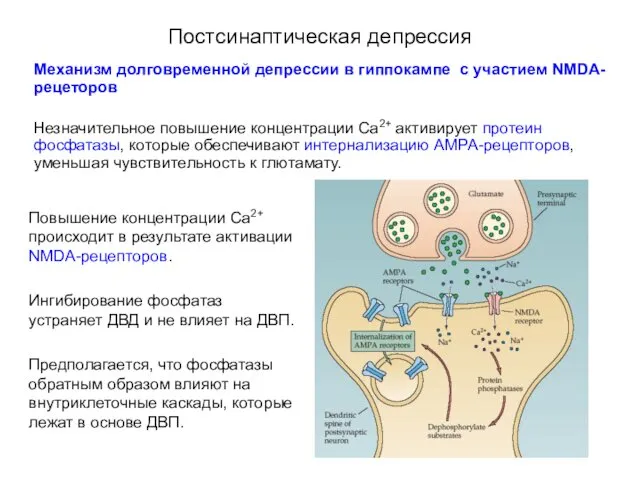
- 70. Постсинаптическая депрессия Механизм долговременной депрессии в гиппокампе с участием NMDA-рецеторов Незначительное повышение концентрации Са2+ активирует протеин
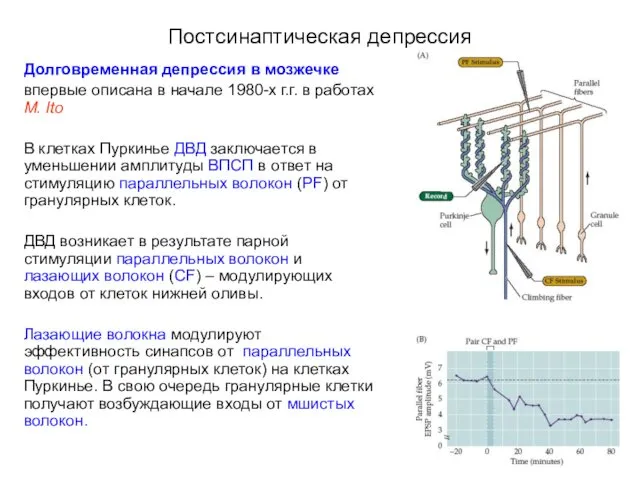
- 71. Постсинаптическая депрессия Долговременная депрессия в мозжечке впервые описана в начале 1980-х г.г. в работах M. Ito
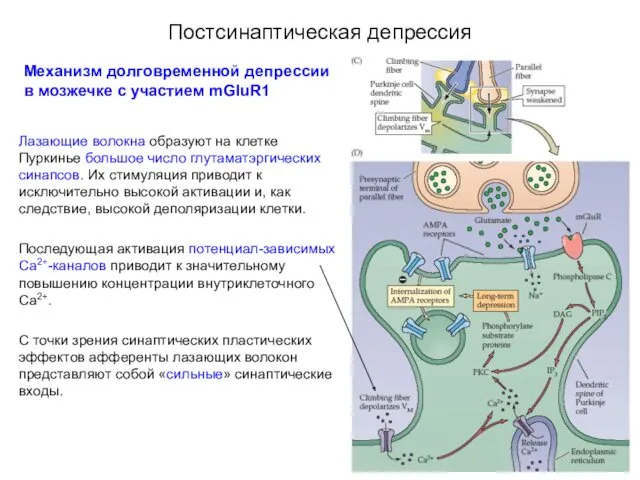
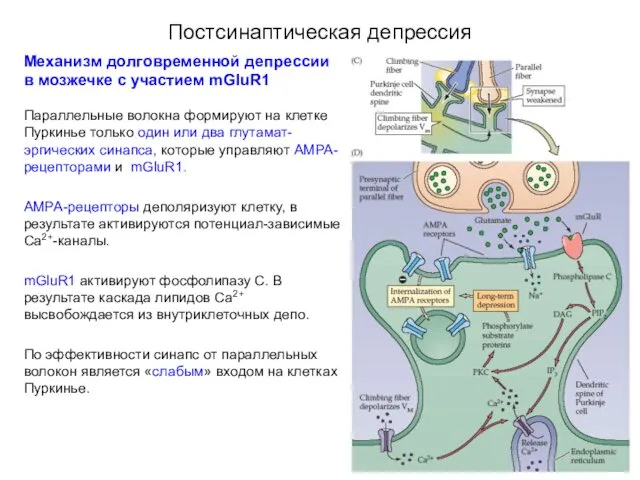
- 72. Постсинаптическая депрессия Механизм долговременной депрессии в мозжечке с участием mGluR1 Лазающие волокна образуют на клетке Пуркинье
- 73. Постсинаптическая депрессия Механизм долговременной депрессии в мозжечке с участием mGluR1 Параллельные волокна формируют на клетке Пуркинье
- 75. Скачать презентацию















 Технологія виробництва птахівництва
Технологія виробництва птахівництва Генрих Гейне 13 декабря 1797 года – 17 февраля 1856 года
Генрих Гейне 13 декабря 1797 года – 17 февраля 1856 года Художественная культура Китая
Художественная культура Китая Эффективные решения для цифровых подстанций и цифровых РЭС
Эффективные решения для цифровых подстанций и цифровых РЭС Наследственная изменчивость. 10 класс
Наследственная изменчивость. 10 класс Возрастные особенности развития речи детей 3-4 лет
Возрастные особенности развития речи детей 3-4 лет Принтеры. Основные типы принтеров
Принтеры. Основные типы принтеров Классификация и определения механизмов. (Лекция 1)
Классификация и определения механизмов. (Лекция 1) Своя православия. Азы Православия. Таинства Церкви
Своя православия. Азы Православия. Таинства Церкви Дидактическая игра. Автоматизация и определение места звука [р] в словах
Дидактическая игра. Автоматизация и определение места звука [р] в словах Ваш ребенок идет в школу
Ваш ребенок идет в школу Презентации по истории химии
Презентации по истории химии Разработка группы жилых домов
Разработка группы жилых домов Центральные и вписанные углы
Центральные и вписанные углы Умные раскрасски
Умные раскрасски Семейное право
Семейное право Химический состав клетки. Вода и ее роль в жизнедеятельности клетки. Минеральные вещества
Химический состав клетки. Вода и ее роль в жизнедеятельности клетки. Минеральные вещества Жизнь и смерть звезд
Жизнь и смерть звезд Решение неравенств, содержащих переменную под знаком модуля
Решение неравенств, содержащих переменную под знаком модуля История создания русской матрешки
История создания русской матрешки Евгений Львович Шварц
Евгений Львович Шварц Робототехника. Системы автоматического управления устройств
Робототехника. Системы автоматического управления устройств Притча о сеятеле
Притча о сеятеле Презентация проекта Я, ты, он, она, вместе - дружная семья
Презентация проекта Я, ты, он, она, вместе - дружная семья Стратегия развития геологической отрасли до 2020 года
Стратегия развития геологической отрасли до 2020 года Проблемы проектирования инфокоммуникационных систем и сетей NGN и пост-NGN. (Лекции 7-8)
Проблемы проектирования инфокоммуникационных систем и сетей NGN и пост-NGN. (Лекции 7-8) Презентация конспекта урока по теме Австралия 11класс
Презентация конспекта урока по теме Австралия 11класс Инструктаж неэлектротехнического персонала ( 1 группа)
Инструктаж неэлектротехнического персонала ( 1 группа)