Слайд 2

Правила составления электронного баланса
Химические элементы, имеющие степень окисления ноль записываются в
электронный баланс с индексом, который переносится в противоположную часть баланса в виде коэффициента и учитывается при подсчете отданных или принятых электронов: Cl20 С60 H12O6
Cl20 + 2e =2Cl–
C60 -24е= 6C+4
Слайд 3

Задание №1
Составьте электронный баланс, укажите окислитель и восстановитель в реакции диспропорционирования
и расставьте коэффициенты в уравнении:
Cl2+KOH = KCl +KClO3 +H2O
Слайд 4

Правила составления электронного баланса
Индекс в балансе сохраняется у элемента, образующего кислотный
остаток:
K2Cr+62O7
Cr2 +6 +6е = Cr2 +3
Слайд 5

Задание №2
Составьте электронный баланс, укажите окислитель и восстановитель и расставьте коэффициенты
в уравнении:
Na2SO3+K2Cr2O7+H2SO4 =Na2SO4+Cr2(SO4)3+K2SO4+H2O
Слайд 6

Правила составления электронного баланса
Индекс в балансе сохраняется у элемента, имеющего дробную
степень окисления и переносится в противоположную часть электронного баланса как коэффициент:
Слайд 7

Задание №3
Составьте электронный баланс, укажите окислитель и восстановитель и расставьте коэффициенты
в уравнении:
Fe3O4+HNO3(конц.) = Fe(NO3)3+NO2+H2O
Слайд 8

Правила составления электронного баланса
Если в сложном веществе несколько элементов меняют степени
окисления, то записываются в электронный баланс с индексом, который переносится в противоположную часть баланса в виде коэффициента и учитывается при подсчете отданных или принятых электронов:
Слайд 9

Правила составления электронного баланса
Если в окислительно-восстановительной реакции степень окисления меняют более
двух элементов, то в электронном балансе суммируются все отданные или принятые электроны и наименьшее общее кратное находится между двумя полученными числами:
Слайд 10

Задание № 4
FeS2+O2=Fe2O3+SO2
Напишите уравнение реакции окисления дисульфида железа(II) концентрированной азотной
кислотой.
Составьте схемы электронного баланса, укажите окислитель и восстановитель и расставьте коэффициенты в уравнении:
Слайд 11
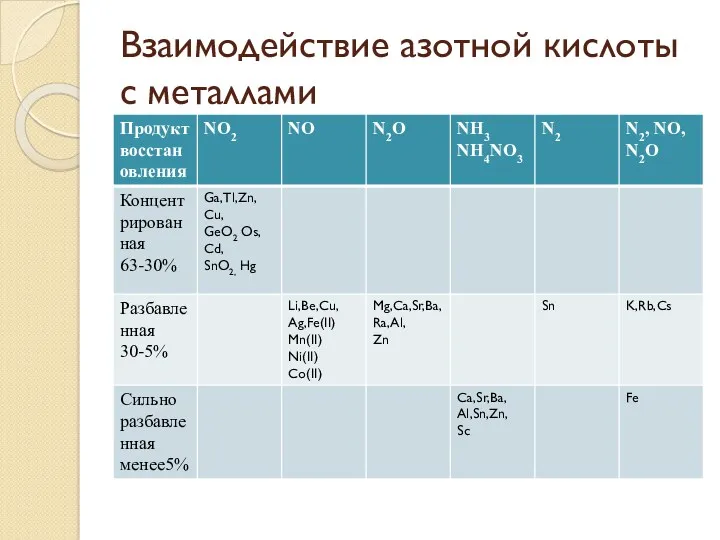
Взаимодействие азотной кислоты с металлами
Слайд 12

Задание №5 Химические свойства соединений азота
Какие два реагента вступили в реакцию,
если получились только следующие вещества ( приведены все продукты реакции без стехиометрических коэффициентов):
а)NaNO2 +NaNO3 +H2O
б) NO +H2O
в)Ca(OH)2 +NH3
г) NO2
Слайд 13

Задачи для подготовки
При растворении5,38г кристаллогидрата сульфата цинка (ZnSO4*XH2O) в 92мл воды
получили раствор с массовой долей сульфата цинка 3,31%. Установите формулу кристаллогидрата.
Образец сплава трех металлов-меди, золота и серебра- обработали избытком азотной кислоты. Не растворившийся осадок высушили и взвесили, его масса оказалась равной 1,97г. Раствор аккуратно упарили досуха. Сухой остаток, масса которого оказалась равной 17,9г прокалили. При этом выделилось 4,48л газа (н.у.). Рассчитайте процентное содержание металлов в сплаве.
Слайд 14

Рекомендуемые для подготовки темы:
Химические свойства и способы получения органических веществ;
Химические свойства
амфотерных соединений алюминия и цинка;
Химические свойства соединений азота;
Разложение нитратов;
Взаимодействие азотной и концентрированной серной кислот с металлами;
Качественные реакции на катионы и анионы в неорганических веществах;
Кристаллогидраты;
Общие формулы, гомологические ряды и изомерия углеводородов;
Термодинамика…













 Примеры решения экономических задач
Примеры решения экономических задач возвратное (1)
возвратное (1) Конституция Российской Федерации
Конституция Российской Федерации Молекулярная биология клетки. Основные концепции современной молекулярной биологии
Молекулярная биология клетки. Основные концепции современной молекулярной биологии Проповедь диакона Филиппа в Самарии. Проповедь апостолов Петра и Иоанна в Самарии
Проповедь диакона Филиппа в Самарии. Проповедь апостолов Петра и Иоанна в Самарии Сигналы оповещения об опасностях, порядок их доведения до населения и действия по ним работников организаций
Сигналы оповещения об опасностях, порядок их доведения до населения и действия по ним работников организаций Сучасні проблеми громадського здоров’я в Україні. Інтегральні показники “ГЗ” та методи їх розрахунку
Сучасні проблеми громадського здоров’я в Україні. Інтегральні показники “ГЗ” та методи їх розрахунку История создания татарского национального костюма
История создания татарского национального костюма Дене шынықтыру және спорт білім беру бағдарламасы
Дене шынықтыру және спорт білім беру бағдарламасы Деревья
Деревья Презентация к классному часу Будьте здоровы
Презентация к классному часу Будьте здоровы Проектирование водосточных систем
Проектирование водосточных систем Мастер класс по теме Развитие коммуникативных способностей детей дошкольного возраста посредством дидактических игр
Мастер класс по теме Развитие коммуникативных способностей детей дошкольного возраста посредством дидактических игр Архитектура второй половины 19 века
Архитектура второй половины 19 века презентацияСтаринная загадка о берёзе
презентацияСтаринная загадка о берёзе Тверская область
Тверская область Гелиоцентрическая система мира
Гелиоцентрическая система мира Презентация Microsoft Office PowerPoint
Презентация Microsoft Office PowerPoint Будущее атомной энергетики. Перспективы развития атомной энергетики
Будущее атомной энергетики. Перспективы развития атомной энергетики Многодетная семья
Многодетная семья Творчество Рембрандта Харменса ван Рейна (1606 — 1669)
Творчество Рембрандта Харменса ван Рейна (1606 — 1669) Законы Ньютона. Решение задач
Законы Ньютона. Решение задач Оказание первой помощи при всех видах острых хирургических заболеваний и травмах
Оказание первой помощи при всех видах острых хирургических заболеваний и травмах Рыночный спрос и предложение. Особенности формирования спроса на лекарственные средства
Рыночный спрос и предложение. Особенности формирования спроса на лекарственные средства Гестоз кезінде жүктілікті, босануды жүргізу. Гестоздың қарқынды терапиясының принциптері
Гестоз кезінде жүктілікті, босануды жүргізу. Гестоздың қарқынды терапиясының принциптері Родительское собрание Курить – здоровью вредить.
Родительское собрание Курить – здоровью вредить. History of the Koenigsegg company
History of the Koenigsegg company Запоминалки
Запоминалки