Содержание
- 2. Проблема. Предлагаемые в учебнике задачи сухие, не интересные, не связанные с жизнью. Цель. Показать роль химии
- 3. ЭТАПЫ РЕАЛИЗАЦИИ С СОДЕРЖАНИЕМ ДЕЯТЕЛЬНОСТИ. Этап 1 Обучение умению создавать задачи. Изучение отношения старшеклассников к задачам
- 4. Ожидаемый результат: Создание задачника. Критерии результативности: Информативность, расширяющая кругозор.
- 5. Методы отслеживания результативности: Сбор отзывов от учащихся, которые решали придуманные задачи. Форма презентации и отчётности: Применение
- 6. ОГЛАВЛЕНИЕ ЗАДАЧНИКА Вычисления массовой доли элементов. Вычисления массовой доли вещества в растворе. Задачи на примеси. Расчёты
- 7. ПРИМЕРЫ ЗАДАЧ, КОТОРЫЕ БУДУТ В НАШЕМ ЗАДАЧНИКЕ
- 8. ВЫЧИСЛЕНИЯ МАССОВОЙ ДОЛИ ЭЛЕМЕНТОВ. Всё сельское хозяйство держится на трёх китах: азот, калий, фосфор. Азот важен
- 9. ДЛЯ ЭТОГО ВОСПОЛЬЗУЕМСЯ ФОРМУЛОЙ НАХОЖДЕНИЯ МАССОВОЙ ДОЛИ ЭЛЕМЕНТА:
- 10. СОЕДИНЕНИЯ КАЛИЯ – ВАЖНЕЙШИЙ БИОГЕННЫЙ ЭЛЕМЕНТ, И ПОТОМУ ПРИМЕНЯЕТСЯ В КАЧЕСТВЕ УДОБРЕНИЙ. Калий крайне полезен в
- 11. ДЛЯ ЭТОГО НАМ НУЖНО ВЫЧИСЛИТЬ ПРОЦЕНТНОЕ СОДЕРЖАНИЕ КАЛИЯ В КАЖДОМ УДОБРЕНИИ ПО ФОРМУЛЕ: После вычислений мы
- 12. ФОСФОР – УДИВИТЕЛЬНО ПОЛЕЗНЫЙ ДЛЯ РАСТЕНИЙ ЭЛЕМЕНТ. ОН УСКОРЯЕТ РАЗВИТИЕ ОРГАНИЗМА, СТИМУЛИРУЕТ ЦВЕТЕНИЕ И ПЛОДОНОШЕНИЕ, БЛАГОПРИЯТСТВУЕТ
- 13. ДЛЯ ЭТОГО МЫ ИСПОЛЬЗУЕМ ФОРМУЛУ МАССОВОЙ ДОЛИ ЭЛЕМЕНТА В ВЕЩЕСТВЕ: Из этих расчётов мы получаем, что
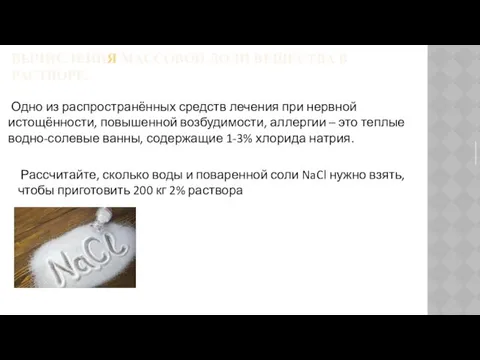
- 14. ВЫЧИСЛЕНИЯ МАССОВОЙ ДОЛИ ВЕЩЕСТВА В РАСТВОРЕ. Одно из распространённых средств лечения при нервной истощённости, повышенной возбудимости,
- 15. ВОСПОЛЬЗУЕМСЯ ФОРМУЛОЙ НАХОЖДЕНИЯ МАССЫ ВЕЩЕСТВА ПРИ ПОМОЩИ МАССОВОЙ ДОЛИ:
- 16. Рассчитайте массу марганцовки и воды, требующиеся для приготовления 50 г 0,4% раствора; 1000 г 0,1% раствора
- 17. ВОСПОЛЬЗУЕМСЯ ФОРМУЛОЙ НАХОЖДЕНИЯ МАССЫ ВЕЩЕСТВА ПРИ ПОМОЩИ МАССОВОЙ ДОЛИ:
- 19. РАСЧЕТ ПО ТЕРМОХИМИЧЕСКИМ РЕАКЦИЯМ Задача 1 Найдите количество вещества, выделившееся при горении 13г ацетилена Получение и
- 20. Дано: Pешение: m(С2Н2)=14г Составим уравнение Найти: 0,05 моль X Кдж Q=? 2C2H2 + 5O2 = 4CO2
- 21. Задача 2 Найдите количество теплоты при горении 93 г фосфора, если выделится 3010 кДж Получение и
- 22. Дано: Решение: m(P)=93г 3 моль X моль Найти: 4P + 5O2 = 2P2O5 + 3010 кДж
- 23. Вычисления доли выхода продукта реакции от теоретически возможного Задача 1 В результате взаимодействия 44,8л оксида азота
- 24. Дано: Решение: m(NH4NO3)=200г Составим уравнение: m(HNO3)=252г NH3+HNO3=NH4+NO3 Найти: 1) n=m:M=252:63=4(моль) Wвыхода=? 2) n=(NHO3)=n(NH4NO3)=4(моль) 3) m=M*n; m(NH4NO3)=80*4=240г
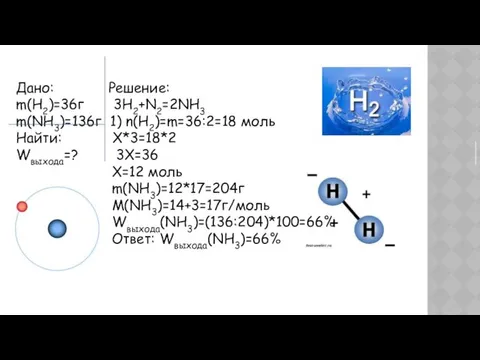
- 25. Задача 2 При взаимодействии 36г водорода с азотом был получен NH3=136г. Определите массовую долю выхода продукта
- 26. Дано: Решение: m(H2)=36г 3H2+N2=2NH3 m(NH3)=136г 1) n(H2)=m=36:2=18 моль Найти: X*3=18*2 Wвыхода=? 3X=36 X=12 моль m(NH3)=12*17=204г M(NH3)=14+3=17г/моль
- 27. Нахождение массовой доли выхода продукта Аммиа́к (нитрид водорода) — химическое cоединение азота и водорода с формулой
- 29. Скачать презентацию
























 Трудности адаптации первоклассников в школе.
Трудности адаптации первоклассников в школе. Осенние именинники 2 класс
Осенние именинники 2 класс Литовская сказка Мальчик золотой хохолок и девочка золотая коса
Литовская сказка Мальчик золотой хохолок и девочка золотая коса Безусловное принятие
Безусловное принятие Виталий Бианки. Лесные домишки
Виталий Бианки. Лесные домишки Снижение рисков возникновения нарушений безопасности движения поездов при производстве маневровой и поездной работы
Снижение рисков возникновения нарушений безопасности движения поездов при производстве маневровой и поездной работы Adobe Photoshop. Коррекция изображений
Adobe Photoshop. Коррекция изображений Discovery & IOC Phase Network Architecture
Discovery & IOC Phase Network Architecture Технико-технологические требования по предупреждению газонефтеводопроявлений
Технико-технологические требования по предупреждению газонефтеводопроявлений Артериальная гипертония
Артериальная гипертония Презентация Все профессии важны
Презентация Все профессии важны Имидж педагога в новой образовательной среде
Имидж педагога в новой образовательной среде Кричалки и разминки для детей дошкольного возраста презентация для педагогов и родителей.
Кричалки и разминки для детей дошкольного возраста презентация для педагогов и родителей. Трудный ребенок
Трудный ребенок Технология успешного трудоустройства
Технология успешного трудоустройства Коляда
Коляда С 23 февраля, дорогие наши мальчики
С 23 февраля, дорогие наши мальчики Бедность и богатство
Бедность и богатство День Российской науки – 8 февраля
День Российской науки – 8 февраля Игры для автоматизации звука Ш
Игры для автоматизации звука Ш Опасности, травмы и заболевания, обусловленные неправильными действиями туристов
Опасности, травмы и заболевания, обусловленные неправильными действиями туристов Тайна имени
Тайна имени Оборудование для приготовления и продажи напитков
Оборудование для приготовления и продажи напитков Gravity Falls
Gravity Falls ВКР: Разработка системы автоматизации добычи и промыслового сбора нефти и газа на месторождении
ВКР: Разработка системы автоматизации добычи и промыслового сбора нефти и газа на месторождении Заикание с позиции логопсихокоррекционного подхода
Заикание с позиции логопсихокоррекционного подхода Программы реновации жилья – общая характеристика, возможность тиражирования опыта
Программы реновации жилья – общая характеристика, возможность тиражирования опыта Технология каменных работ
Технология каменных работ