Содержание
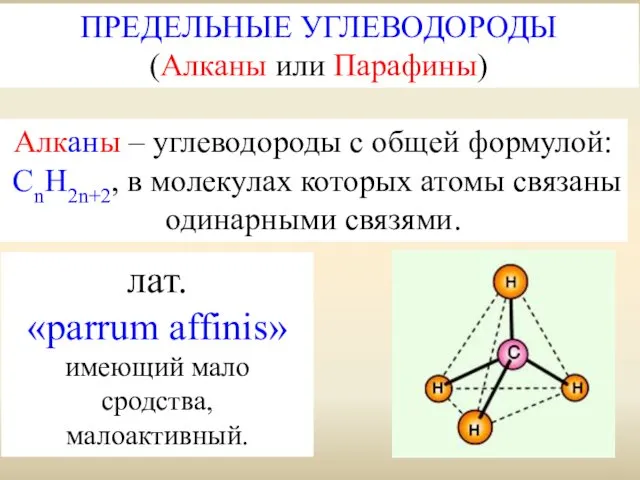
- 2. Алканы – углеводороды с общей формулой: СnH2n+2, в молекулах которых атомы связаны одинарными связями. ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
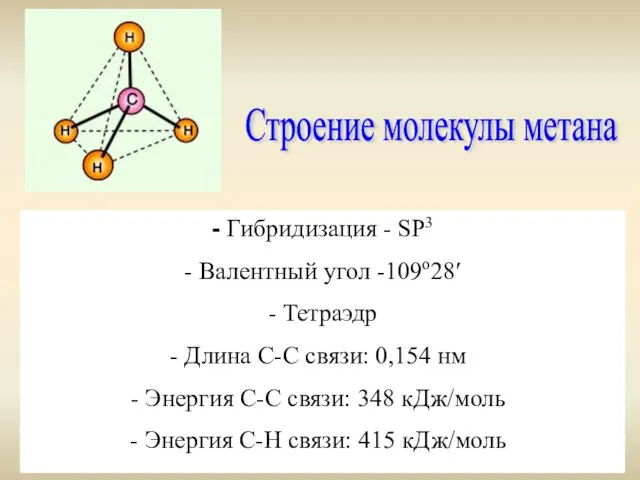
- 3. Строение молекулы метана - Гибридизация - SР3 - Валентный угол -109о28′ - Тетраэдр Длина С-С связи:
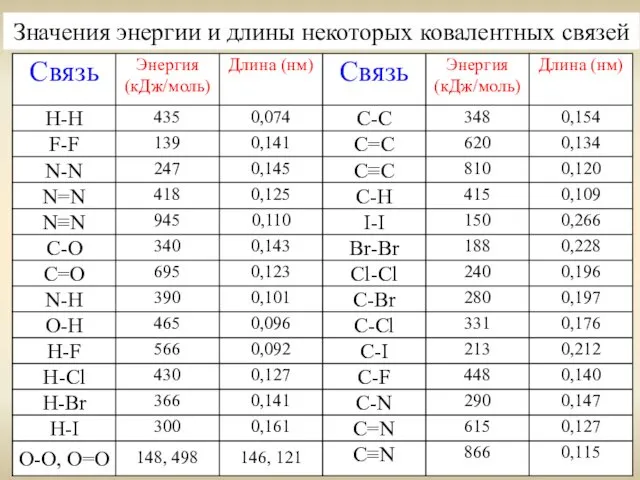
- 4. Значения энергии и длины некоторых ковалентных связей
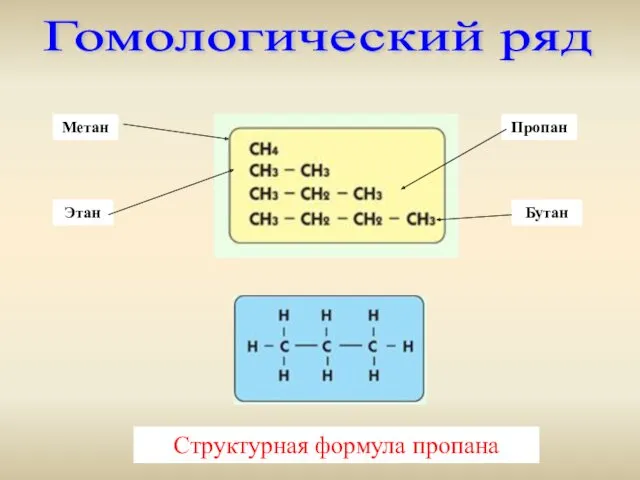
- 5. Гомологический ряд Метан Этан Пропан Бутан Структурная формула пропана
- 6. Модель молекулы пентана Алканы с большим числом атомов углерода имеют зигзагообразное строение.
- 7. Изомерия Структурная изомерия (УС) проявляется при содержании в цепи 4-х и более атомов углерода, т. е.
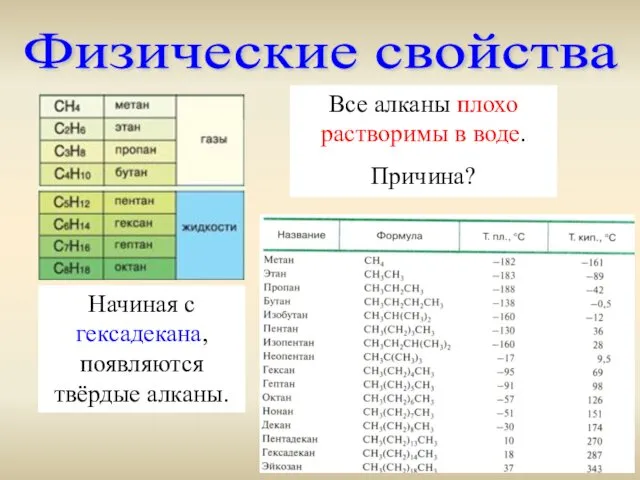
- 8. Физические свойства Все алканы плохо растворимы в воде. Причина? Начиная с гексадекана, появляются твёрдые алканы.
- 9. Получение ПУВ реакцией гидрирования Циклоалканов: С5Н10 + Н2 = С5Н12 Алкинов: С2Н2 + 2Н2 = С2Н6
- 10. В лаборатории ПУВ получают сплавлением ацетата натрия со щелочью (р-я Дюма): t°C R-COONa + NaO-H ⎯⎯→
- 11. Синтез Вюрца 1855г. RHal + 2Na + R'Hal → R-R' + 2NaHal проводится с целью получения
- 12. Способ Кольбе (электролиз) 2RCOONa (р-в)→ R-R + 2CO2 + 2Na 2RCOONa + 2H2O → R-R +
- 13. При электролизе водного раствора соли активного металла органической кислоты на катоде выделяется водород, на аноде углеводород
- 14. Метан в лаборатории можно получить гидролизом карбида алюминия: Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
- 15. Химические свойства 1 - реакции замещения 2- реакции дегидрирования 3 - реакции горения 4 - реакции
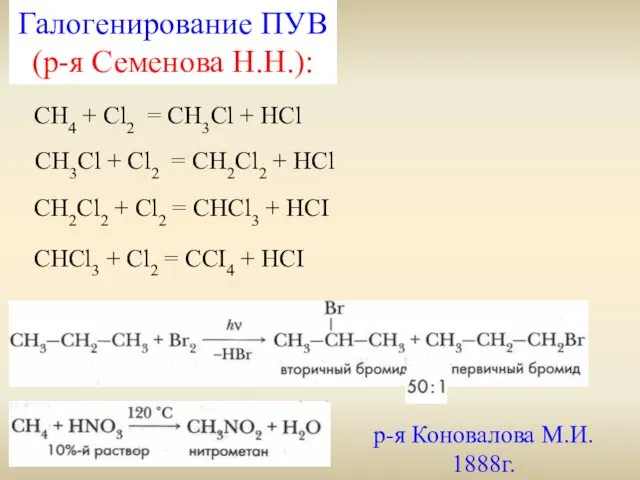
- 16. CH4 + Cl2 = CH3Cl + HCl CH3Cl + Cl2 = CH2Cl2 + HCl CH2Cl2 +
- 17. В реакциях замещения атака реагента на субстрат осуществляется избирательно по правилу: С первичный Это правило реализуется
- 18. При дегидрировании алканов образуются непредельные углеводороды: Например, дегидрирование пентана: С5Н12 С5Н10 + Н2 пентен
- 19. Все алканы горят с образованием углекислого газа и воды: 2С4Н10 + 13О2 = 8СО2 + 10Н2О
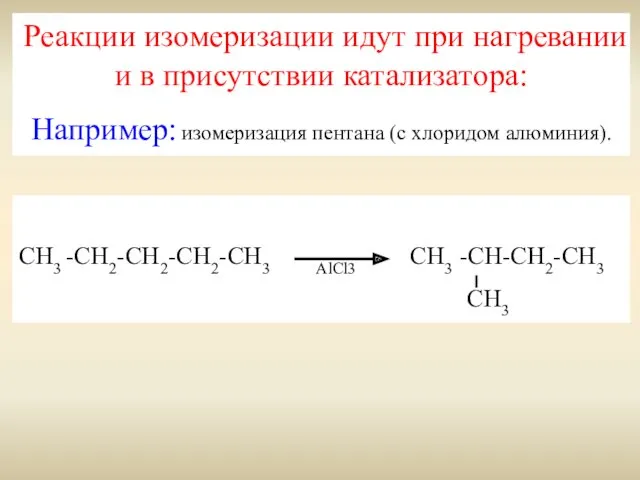
- 20. Реакции изомеризации идут при нагревании и в присутствии катализатора: Например: изомеризация пентана (с хлоридом алюминия). СН3
- 22. Скачать презентацию












 Геометрия 14.04.2020
Геометрия 14.04.2020 Мир Искусства
Мир Искусства Организация учебно-методической деятельности ПОО на основе автоматизированной системы 1С:Колледж
Организация учебно-методической деятельности ПОО на основе автоматизированной системы 1С:Колледж Презентация к уроку по теме: Вселенная
Презентация к уроку по теме: Вселенная Приобретенные пороки сердца
Приобретенные пороки сердца Культура Руси XIII-XIV веков
Культура Руси XIII-XIV веков Психикалық ауруларды зерттеу мен диагностика әдістерінің ерекшелігі
Психикалық ауруларды зерттеу мен диагностика әдістерінің ерекшелігі Авиационная, высотная, космическая физиология. Особенности адаптации человека к условиям космоса
Авиационная, высотная, космическая физиология. Особенности адаптации человека к условиям космоса Морфологический разбор имён существительных. 5 класс
Морфологический разбор имён существительных. 5 класс 20231031_konflikt_pokoleniy_v_itogovom_sochinenii_na_primere_proizvedeniy_russkoy_literatury_xix_veka_
20231031_konflikt_pokoleniy_v_itogovom_sochinenii_na_primere_proizvedeniy_russkoy_literatury_xix_veka_ Изготовление цилиндрических деталей ручным инструментом
Изготовление цилиндрических деталей ручным инструментом Кто он, педагог будущего?
Кто он, педагог будущего? Розвиток доктрини про Трійцю
Розвиток доктрини про Трійцю Правила прийому на навчання до Чорноморського державного університету імені Петра Могили
Правила прийому на навчання до Чорноморського державного університету імені Петра Могили Технология изготовления юбки
Технология изготовления юбки Достопримечательности Тарусы на англ. языке
Достопримечательности Тарусы на англ. языке Сказки народов Севера
Сказки народов Севера Подготовка нефти. Обезвоживание нефти
Подготовка нефти. Обезвоживание нефти Викторина Святитель Стефан - апостол Пермской земли
Викторина Святитель Стефан - апостол Пермской земли ГПД: мозаика Грибной дождь
ГПД: мозаика Грибной дождь Пересечение и объединение множеств
Пересечение и объединение множеств Презентация к уроку Внутренние воды Южной Америки
Презентация к уроку Внутренние воды Южной Америки Периодическая система элементов Д.И. Менделеева
Периодическая система элементов Д.И. Менделеева Материалы с высокими упругими свойствами
Материалы с высокими упругими свойствами Langage d’assemblage. Architecture et technologie des ordinateurs
Langage d’assemblage. Architecture et technologie des ordinateurs Индивид. Индивидуальность. Личность
Индивид. Индивидуальность. Личность Экспорт (2)
Экспорт (2) Презентация Модель трех вопросов
Презентация Модель трех вопросов