Содержание
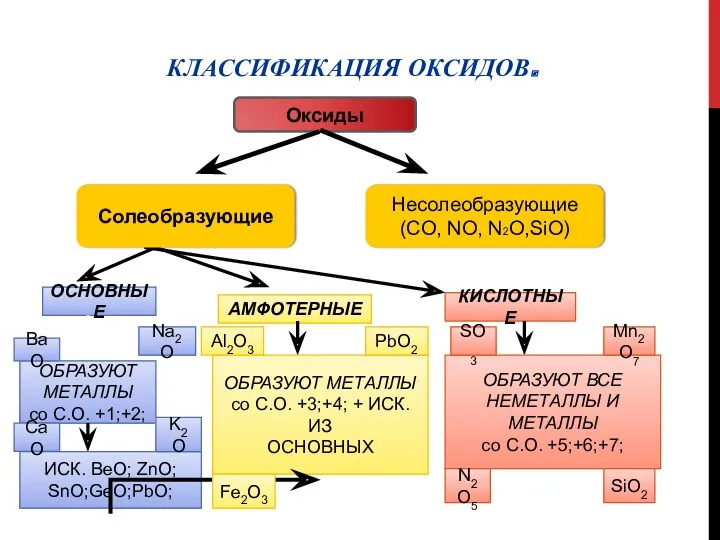
- 2. КЛАССИФИКАЦИЯ ОКСИДОВ. ОСНОВНЫЕ АМФОТЕРНЫЕ КИСЛОТНЫЕ ОБРАЗУЮТ ВСЕ НЕМЕТАЛЛЫ И МЕТАЛЛЫ со С.О. +5;+6;+7; ОБРАЗУЮТ МЕТАЛЛЫ со
- 3. 1. Какие вещества называются оксидами? 2. Игра «Найди родственников». Из приведенных формул выберите формулы оксидов и
- 4. ТЕСТ №1 1. Среди следующих формул оксидом является: 1) НСl 2) Na2SO4 3) Na2O 4) NaOH.
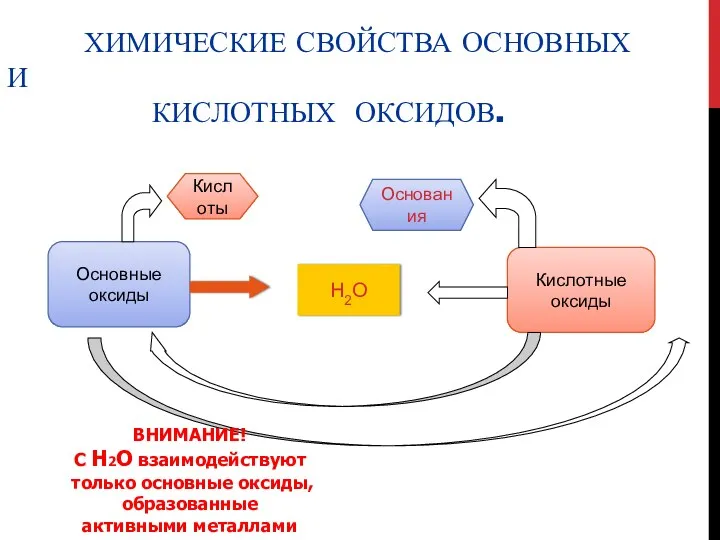
- 5. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ И КИСЛОТНЫХ ОКСИДОВ. Основные оксиды Кислотные оксиды Кислоты H2O Основания ВНИМАНИЕ! С H2O
- 6. а) Химические свойства основных оксидов: 1) Взаимодействуют с кислотами, образуя соль и воду: основной оксид +
- 7. ВИДЕОФРАГМЕНТ.
- 8. ТЕСТ № 2 1. С серной кислотой будет взаимодействовать: 1) SO3 2) Mn2O7 3) N2O5 4)
- 9. Химические свойства кислотных оксидов: 1) Взаимодействуют с основаниями, образуя соль и воду: кислотный оксид + основание
- 10. ВИДЕОФРАГМЕНТ
- 11. ТЕСТ № 3 1. С гидроксидом натрия будет реагировать: 1) СаО 2) СО 3) SO3 4)
- 12. Получение оксидов: 1) Взаимодействие простых веществ с кислородом: 4Р +5О2 =2Р2О5 избыток 4Р + 3О2 =
- 13. 3) Разложение сложных веществ: нерастворимых оснований: нерастворимое основание → оксид + Н2О Mg(OH)2 → MgO +H2O
- 14. ТЕСТ № 4 1. Коэффициент перед формулой кислорода в уравнении реакции, схема которой Аl + O2
- 16. Скачать презентацию











 Экологические знаки
Экологические знаки Презентация Родители в жизни школы
Презентация Родители в жизни школы Игра Поле- чудес Вкусненько - полезненько
Игра Поле- чудес Вкусненько - полезненько Поволжье
Поволжье Презентация к занятию_Умей сказать НЕТ
Презентация к занятию_Умей сказать НЕТ Основные требования и идеи ФГОС на уроке
Основные требования и идеи ФГОС на уроке Отчет Тверского регионального отделения Межрегиональной общественной организации детей-инвалидов и их родителей Дети-Ангелы
Отчет Тверского регионального отделения Межрегиональной общественной организации детей-инвалидов и их родителей Дети-Ангелы What’s hiding?
What’s hiding? О первоочередных задачах деятельности филиала ПАО МРСК ЦЕНТРАБРЯНСКЭНЕРГО
О первоочередных задачах деятельности филиала ПАО МРСК ЦЕНТРАБРЯНСКЭНЕРГО Забобони та повір’я українців
Забобони та повір’я українців Безопасное выполнение погрузочно-разгрузочных работ
Безопасное выполнение погрузочно-разгрузочных работ Изгибаемые элементы. Расчет прочности нормальных сечений. Тема 7
Изгибаемые элементы. Расчет прочности нормальных сечений. Тема 7 Текстовые редакторы. Урок 10
Текстовые редакторы. Урок 10 Балық және балық өнімдерін алу технологиясы
Балық және балық өнімдерін алу технологиясы СОЛИ
СОЛИ Рак гортани
Рак гортани Технологическое и комплектующее оборудование технических средств службы горючего. (Тема 4.1)
Технологическое и комплектующее оборудование технических средств службы горючего. (Тема 4.1) Методическая разработка:Технология реализации проекта - презентация Зимующие птицы
Методическая разработка:Технология реализации проекта - презентация Зимующие птицы Отчёт о прохождении производственной практики
Отчёт о прохождении производственной практики The Stock Market
The Stock Market Методическая разработка занятия по вопросам охраны труда
Методическая разработка занятия по вопросам охраны труда Шрифт. Виды шрифтов. 6 класс
Шрифт. Виды шрифтов. 6 класс Осевая симметрия геометрия 9 класс
Осевая симметрия геометрия 9 класс Национальные религии. Синтоизм
Национальные религии. Синтоизм Про Деда Мороза и его подарки
Про Деда Мороза и его подарки Презентация -Редкие породы кошек
Презентация -Редкие породы кошек Использование пестицидов в сельском хозяйстве
Использование пестицидов в сельском хозяйстве Презентация Развитие словесно логического мышления у дошкольников с ОНР Карих Э.М.
Презентация Развитие словесно логического мышления у дошкольников с ОНР Карих Э.М.