Слайд 2

Общая характеристика:
Общая формула непредельных
CnH2n CnH2n -2
Вопросы:
1.Вспомните и
напишите общую формулу предельных углеводородов?
2.Как можно получить непредельный углеводород? (напишите соответствующее уравнение реакции) .
3. Предположите , исходя из общей формулы, какие реакции будут характерны для алкенов?
Слайд 3

Гомологический ряд алкенов
Задание: Пользуясь общей формулой составьте гомологический ряд этилена. Впишите
в слайд химические формулы, названия и сокращённые структурные формулы гомологов этилена.
Проверьте себя по следующему слайду.
Слайд 4

Гомологический ряд алкенов
C2H4 -этилен, этен CH2= CH2
C3H6 – пропилен,пропен CH2=CH-CH3
C4H8 – бутилен, бутен CH2=CH-CH2-CH3
C5H10 – пентилен, пентен CH2=CH-CH2-CH2-CH3
C6H12- гексилен, гексен CH2=CH-CH2-CH2-CH2-CH3
C7H14-гептилен, гептен CH2=CH-CH2-CH2-CH2-CH2-CH3
C8H16- октилен, октен CH2=CH-CH2-CH2-CH2-CH2-CH2CH3
C9H18- нонилен, нонен
CH2=CH-CH2-CH2-CH2-CH2-CH2-CH-CH3
C10H20- декилен, декен
CH2=CH-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Слайд 5
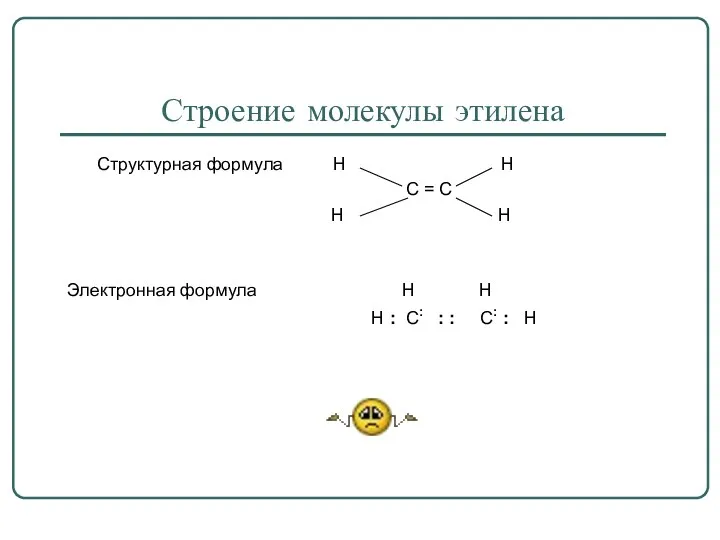
Строение молекулы этилена
Структурная формула H H
C = C
H H
Электронная формула H H
H : C: : : C: : H
Слайд 6

Способы получения непредельных углеводородов
Дегидрирование предельных
H H H H 550
-650oC
H-C – C- H => H - C = C – H + H2 или 2CH4 C2H4 +H2
H H
При нагревании смеси этилового спирта с концентрированной серной кислотой
t
C2H5OH H2C=CH2 +HOH (реакция дегидратации*)
H2SO4 конц
На производстве из природного газа и в процессе крекинга нефти
Взаимодействием дигалагенпроизводных предельных углеводородов с металлами
CH2Br – CHBr – CH3 + Zn H2C =CH – CH3 +ZnBr2
1,2 – дибромпропан пропилен
Если атомы галагенов находятся не у соседних атомов, то могут образовываться циклопарпфины
Слайд 7
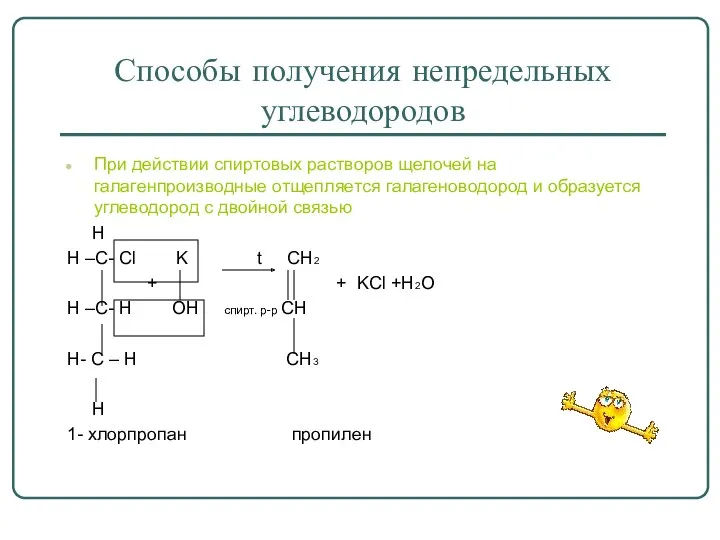
Способы получения непредельных углеводородов
При действии спиртовых растворов щелочей на галагенпроизводные отщепляется
галагеноводород и образуется углеводород с двойной связью
H
H –C- Cl K t CH2
+ + KCl +H2O
H –C- H OH спирт. р-р CH
H- C – H CH3
H
1- хлорпропан пропилен
Слайд 8

Реакции разложения, в результате которых от молекул веществ отщепляется вода, называются
реакциями дегидратации
Слайд 9
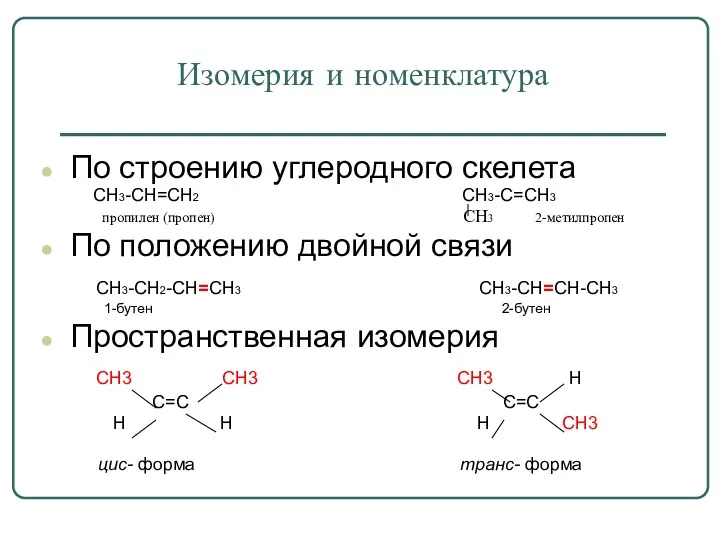
Изомерия и номенклатура
По строению углеродного скелета
CH3-CH=CH2 CH3-C=CH3
пропилен (пропен) CH3
2-метилпропен
По положению двойной связи
CH3-CH2-CH=CH3 CH3-CH=CH-CH3
1-бутен 2-бутен
Пространственная изомерия
СH3 CH3 CH3 H
C=C C=C
H H H CH3
цис- форма транс- форма
Слайд 10

Физические свойства алкенов
Этилен – бесцветный газ, почти без запаха, немного легче
воздуха, плохо растворим в воде.
Пропилен и бутены (бутилены) при нормальных условиях также газообразны, от пентана С5H10 до октадецена C18H36 углеводороды находятся в жидком состоянии, начиная с нонадецена C19H38 – в твёрдом.
Слайд 11

Химические свойства
Определяются наличием в их молекулах двойной связи.
Для них характерны
реакции:
Присоединения,
Окисления,
Полимеризации.
Слайд 12

Реакции присоединения
1.Этилен и его гомологи взаимодействуют с галагенами (обесцвечивают бромную воду)
H2C=CH2+Br2 CH2Br-CH2Br 1,2-дибромэтан
2.Аналогично происходит присоединение водорода (гидирование этилена и его гомологов): H2C=CH2+H2 H3C-CH3
катализатор, t
, 3.В присутствии серной или ортофосфорной кислоты и др. катализаторов этилен присоединяет воду (реакция гидратации): H2C=CH2+HOH CH3-CH2-OH
этилен катализатор, t этиловый спирт
4.Этилен и его гомологи присоединяют галагеноводороды*:
H2C=CH2 + HBr CH3-CH2Br; H2C=CH2+HCl CH3-CH2Cl
этилбромид этилхлорид
*Пропилен и последующие углеводороды ряда этилена реагируют с галагеноводородами согласно правилу В.В. Марковникова.
Водород присоединяется к наиболее, а атом галогена – к наименее гидрированному атому углерода.
Слайд 13

Реакции окисления
1.Этилен и его гомологи способны гореть в воздухе:
C2H4+3O2
2CO2 +2H2O
С воздухом этилен и его гомологи образуют взрывчатые смеси!!!
2.Этилен и его гомологи легко окисляются, например кислородом перманганата калия. При этом раствор последнего обесцвечивается
KMnO4 CH2=CH2+O+H2O HO-CH2-CH2-OH
этиленгликоль
3. Большое промышленное значение имеет частичное окисление этилена кислородом воздуха: 150 – 350 o C, Ag
2CH2=CH2 + O2 2H2C-CH2
O
Слайд 14

Реакции полимеризации
Реакции, в которых происходит соединение молекул исходного вещества в огромную
молекулу.
Исходные вещества называются мономером,а продукт реакции полимерами
Слайд 15

Реакции полимеризации
При повышенной температуре, давлении и в присутствии катализаторов молекулы этилена
соединяются друг с другом вследствие разрыва двойной связи
AL(C2H5)3
n CH2=CH2 ( -CH2-CH2-) n
этилен t,давление полиэтилен
Слайд 16

Применение углеводородов ряда этилена
Этилхлорид CH3-CH2Cl применяют в медицине для местной анестезии;
Этиленгликоль
HO-CH2-CH2-OH для производства труднозамерзающих жидкостей – антифризов, а также синтетического волокна лавсана, взрывчатых веществ;
Оксид этилена C2H4O используют для синтеза различных органических веществ, для производства уксусного альдегида, синтетических моющих веществ, лаков, пластмасс, синтетических каучуков и волокон, косметических препаратов и многих других ценных продуктов;
Полиэтилен и полипропилен химически очень прочны, поэтому их используют для изготовления оборудования в различных отраслях промышленности (аппараты, трубы, сосуды и т.д.). Они обладают хорошими электроизоляционными свойствами. В тонком слое эти материалы хорошо пропускают ультрафиолетовые лучи, поэтому их используют вместо стекла в парниках и теплицах. Широко применяют для упаковки разных продуктов.
Если в молекуле этилена все атомы водорода заменить атомами фтора, то получится тетрафторэтилен CF2=CF2. При полимеризации получают политетрафторэтилен, или тефлон (-CF2-CF2-)n –механически прочное и химически очень стойкое вещество. Тефлон по химическим свойствам превосходит все металлы, даже золото и платину. Он выдерживает температуру до 260С, не горит и является отличным диэлектриком















 Физминутка для глаз Нарисуй буквы
Физминутка для глаз Нарисуй буквы Ряды динамики и их использование в экономике и праве
Ряды динамики и их использование в экономике и праве Множественность преступлений. Формы множественности преступлений
Множественность преступлений. Формы множественности преступлений Полезная сказка на новый лад
Полезная сказка на новый лад Д.Егор Бабушка
Д.Егор Бабушка только ли лист кормит растение?
только ли лист кормит растение? Внеурочная деятельность . Фильм, фильм, фильм..
Внеурочная деятельность . Фильм, фильм, фильм.. Викторина Угадай слово
Викторина Угадай слово Тренировочная программа пловца с ампутацией обеих ног в средней трети голени
Тренировочная программа пловца с ампутацией обеих ног в средней трети голени Правописание суффиксов разных частей речи и личных окончаний глаголов. (ОГЭ. Задание 5)
Правописание суффиксов разных частей речи и личных окончаний глаголов. (ОГЭ. Задание 5) Интерактивная игра Пернатые друзья
Интерактивная игра Пернатые друзья Педагогическое мастерство учителя иностранного языка
Педагогическое мастерство учителя иностранного языка Моделирование, основные понятия и определения, виды и методы идентификации статических моделей
Моделирование, основные понятия и определения, виды и методы идентификации статических моделей Физиологическое значение двигательной активности в развитии детей раннего возраста.
Физиологическое значение двигательной активности в развитии детей раннего возраста. Русская литература второй половины XIX века (повторение)
Русская литература второй половины XIX века (повторение) следственные действия
следственные действия Дидактические игры для формирования слоговой структуры слова.
Дидактические игры для формирования слоговой структуры слова. Республиканская профильная смена с дневным пребыванием
Республиканская профильная смена с дневным пребыванием psikh_ped_2
psikh_ped_2 Принципы размещения подземных инженерных сетей. Способы прокладки инженерных сетей
Принципы размещения подземных инженерных сетей. Способы прокладки инженерных сетей Французская Республика
Французская Республика 11 класс. Китай. Диск
11 класс. Китай. Диск Нитриды и их применение
Нитриды и их применение Обмен электронными счетамифактурами и другими документами ООО “Комацу СНГ”
Обмен электронными счетамифактурами и другими документами ООО “Комацу СНГ” Опорно-двигательный аппарат. Скелет головы и туловища
Опорно-двигательный аппарат. Скелет головы и туловища Презентация ко Дню Матери
Презентация ко Дню Матери Отчет о проведении Всероссийского фестиваля энергосбережения и экологии #ВместеЯрче-2021 городской округ город Лабытнанги
Отчет о проведении Всероссийского фестиваля энергосбережения и экологии #ВместеЯрче-2021 городской округ город Лабытнанги Admissions statistics on undergraduate programs
Admissions statistics on undergraduate programs