Содержание
- 2. Моль – такое количество вещества, в котором содержится 6∙1023 молекул этого вещества. Молярная масса – масса
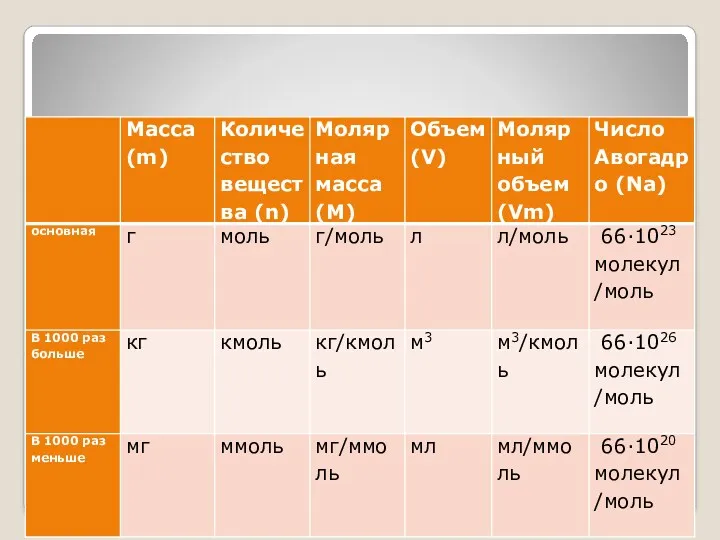
- 3. Буквенные обозначения: Количество вещества - n Молярный объем - Vm Молярная масса - M Масса -
- 4. Основные формулы
- 5. Массовая доля. Массовая доля элементов в веществе. Буквенные обозначения ω – массовая доля (в долях от
- 6. Массовая и объемная доли компонентов смеси (раствора). Буквенные обозначения ω – массовая доля (в долях от
- 7. Расчет массовой или объемной доли выхода продукта реакции от теоретически возможного. Выход продукта реакции от теоретически
- 8. Расчет теплового эффекта реакции. Экзотермические реакции – протекают с выделением теплоты +Q Эндотермические реакции – протекают
- 9. Алгоритм решения задачи . Внимательно прочтите условия задачи 2-3 раза. 2. Кратко запишите, что дано (известно)
- 10. Задачи 1.Определите объем (н.у.) сероводорода массой 13,6 г. 2.Определите массу кислорода объемом 33,6 л(н.у.) 3.Газовая смесь
- 11. 5. Оксид элемента имеет состав ЭО3 Массовая доля кислорода в этом оксиде составляет 60%. Определите какой
- 12. Хлорид элемента имеет состав ЭСl2 Массовая доля хлора в этом хлориде составляет 52,21%. Определите какой элемент
- 13. Определите молярную массу оксида углерода, плотность которого по воздуху составляет 1,51. Какой это оксид углерода?
- 14. Решить самостоятельно
- 15. Массовые доли углерода, азота и водорода равны соответственно 53,33, 31,11 и 15,5%. Вывести молекулярную формулу. Массовые
- 16. Задачи на растворы
- 17. В 300 г воды растворили 20 г глюкозы. Определите массовую долю глюкозы в полученном растворе. Вычислите
- 18. Из 10 кг раствора с массовой долей хлорида натрия 20% при охлаждении выделилось 400г. соли. Чему
- 19. Какую массу раствора с массовой долей гидроксида калия 20% надо прибавить к 1 кг раствора с
- 20. Вычислить среднюю скорость реакции CO + NO2 = CO2 + NO если начальная концентрация CO была
- 21. Задачи по теме скорость химических реакций
- 22. Как изменится скорость химической реакции при повышении температуры реакционной смеси от 20 градусов до 50, если
- 23. Во сколько раз изменится скорость реакции, уравнение которой 2NO + O2 = 2NO2 При увеличении концентрации
- 24. При температуре 20 градусов некоторая реакция заканчивается через 40 минут. Вычислить, через сколько минут закончится эта
- 25. Вычислите как изменится скорость реакции: а) при повышении температуры на 30 градусов. б) при понижении температуры
- 27. Скачать презентацию























 Измерение температуры
Измерение температуры Требования безопасности на маршруте экскурсии
Требования безопасности на маршруте экскурсии Презентация к родительскому собранию на тему Безопасность детей в Интернете
Презентация к родительскому собранию на тему Безопасность детей в Интернете Мастер-класс как сделать стенд календарь природы своими руками автор: Тухватуллина в. Р.
Мастер-класс как сделать стенд календарь природы своими руками автор: Тухватуллина в. Р. Социальная защита населения
Социальная защита населения Международная защита прав человека
Международная защита прав человека презентация по технологии Объёмная снежинка
презентация по технологии Объёмная снежинка Мікропроцесорна техніка
Мікропроцесорна техніка Faýl sistemasy barada düşünje faýla barýan ýol faýlyň möçberi faýl guramaçylary(menejerler) “ýolbelet” programma
Faýl sistemasy barada düşünje faýla barýan ýol faýlyň möçberi faýl guramaçylary(menejerler) “ýolbelet” programma Требования законодательства в области лицензирования деятельности по сбору, утилизации, размещению отходов I-IV класса опасности
Требования законодательства в области лицензирования деятельности по сбору, утилизации, размещению отходов I-IV класса опасности Презентация Права ребенка
Презентация Права ребенка Как добиться прозрачности и контролируемости бизнеса
Как добиться прозрачности и контролируемости бизнеса Новый год к нам мчится...
Новый год к нам мчится... Анализ и оценка внешних климатических условий и меры регулирования
Анализ и оценка внешних климатических условий и меры регулирования Стрітення
Стрітення Принятие христианство на Руси
Принятие христианство на Руси Орган зрения и зрительный анализатор
Орган зрения и зрительный анализатор Проект по экологии на тему: Засоренность окружающей среды бытовыми отходами вокруг села Кырен
Проект по экологии на тему: Засоренность окружающей среды бытовыми отходами вокруг села Кырен Анализ ассортимента, оценка качества и основы экспертизы копченых-колбас на примере торговой организации города Севастополя
Анализ ассортимента, оценка качества и основы экспертизы копченых-колбас на примере торговой организации города Севастополя Источниковая база для написания проектных и исследовательских работ
Источниковая база для написания проектных и исследовательских работ Способы бурения шпуров, буровое оборудование
Способы бурения шпуров, буровое оборудование Образование взгляд в будущее. Проблемы, перспективы, прогнозы
Образование взгляд в будущее. Проблемы, перспективы, прогнозы Общая характеристика основных видов транспорта нефти, нефтепродуктов и газа. Лекция №1
Общая характеристика основных видов транспорта нефти, нефтепродуктов и газа. Лекция №1 Санитарно-просветительная работа. Формирование ЗОЖ. Тема 16
Санитарно-просветительная работа. Формирование ЗОЖ. Тема 16 Расчет экономической составляющей дизайн-проекта трехкомнатной квартиры
Расчет экономической составляющей дизайн-проекта трехкомнатной квартиры Электронное колье NeckTec: носимый компьютер будущего
Электронное колье NeckTec: носимый компьютер будущего Обструктивные уропатии
Обструктивные уропатии Академия наук
Академия наук