Содержание
- 2. 1. СН3 - СН3 2. СН2 = СН2 3. СН ≡ СН 4. СН2 = СН
- 3. Ацетилен и его гомологи.
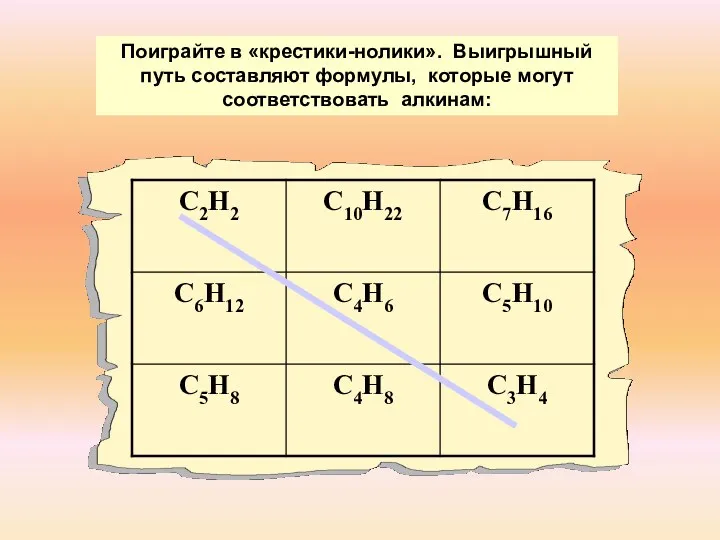
- 4. Поиграйте в «крестики-нолики». Выигрышный путь составляют формулы, которые могут соответствовать алкинам:
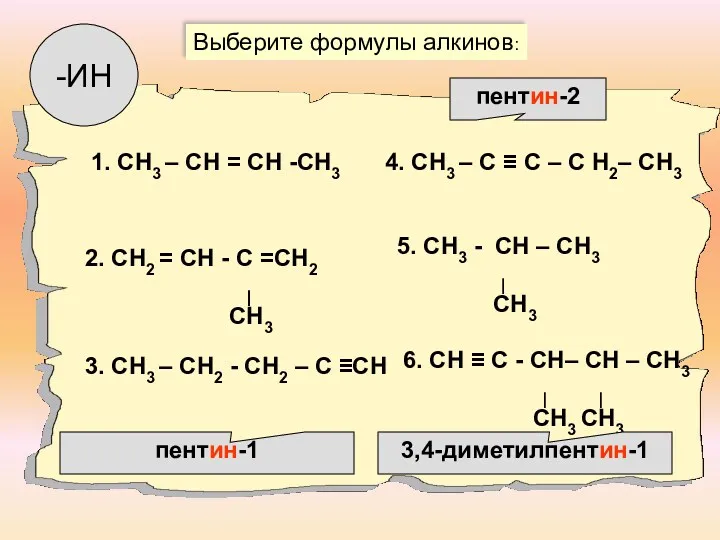
- 5. 1. СН3 – СН = СН -СН3 2. СН2 = СН - С =СН2 ∣ СН3
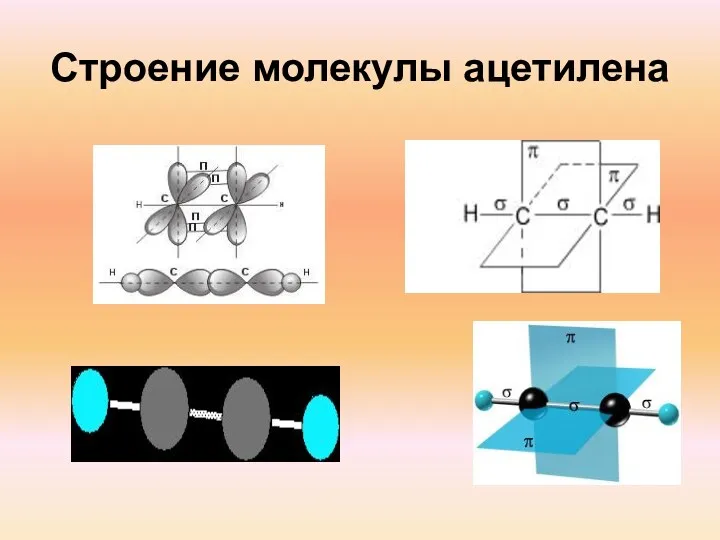
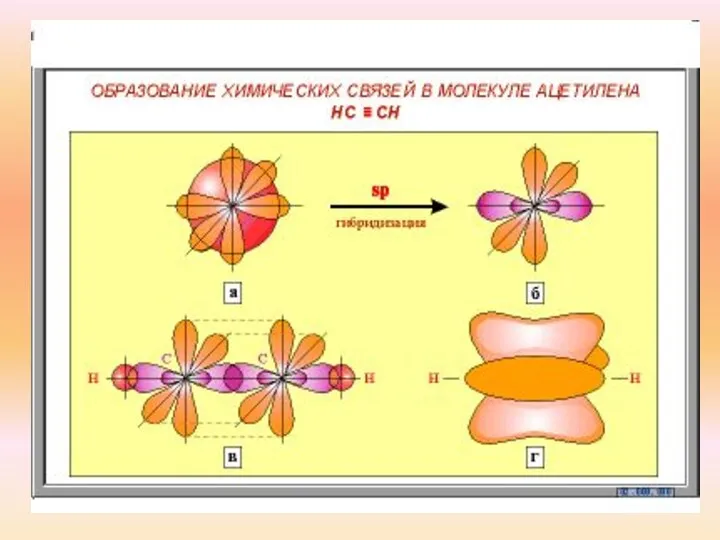
- 6. Строение молекулы ацетилена
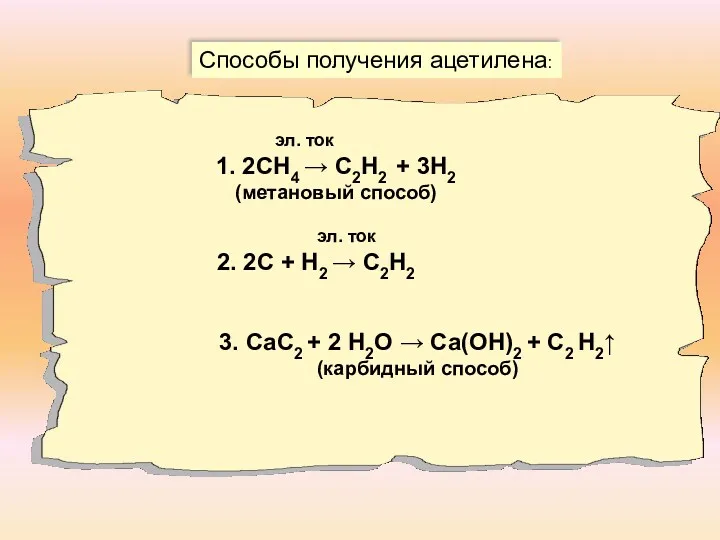
- 11. Способы получения ацетилена: эл. ток 1. 2СН4 → С2Н2 + 3Н2 (метановый способ) эл. ток 2.
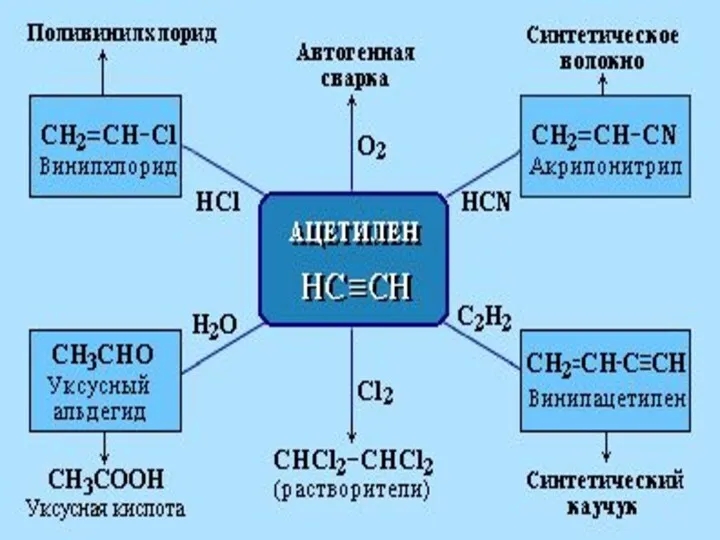
- 12. Химические свойства РЕАКЦИЯ ГОРЕНИЯ 2СН ≡ СН + 5О2 → 4СО2 + 2Н2О
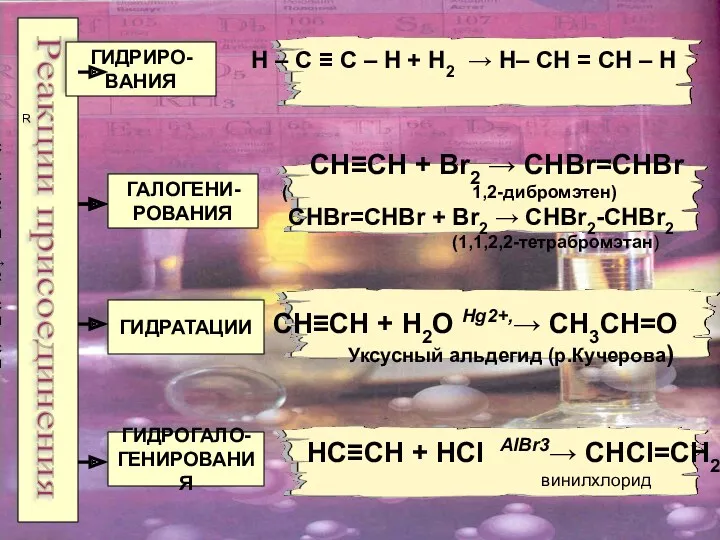
- 13. Реакции присоединения ГИДРИРО- ВАНИЯ ГАЛОГЕНИ- РОВАНИЯ ГИДРАТАЦИИ ГИДРОГАЛО- ГЕНИРОВАНИЯ CH≡CH + H2O Hg2+,→ CH3CH=O Уксусный альдегид
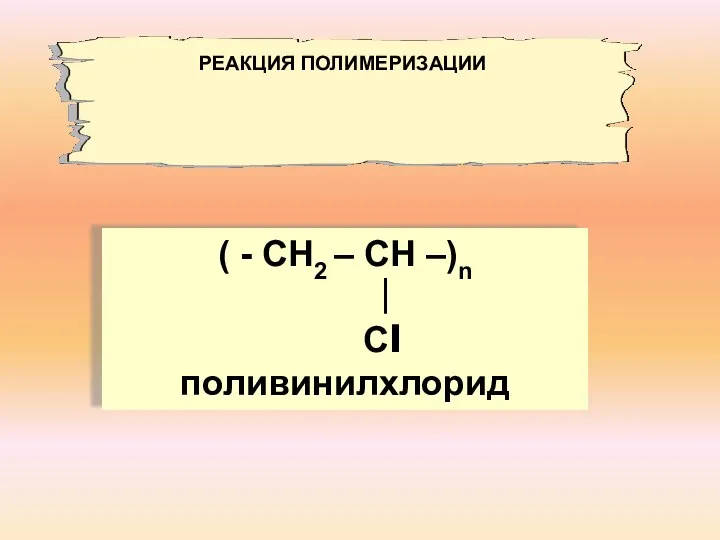
- 14. ( - СН2 – СН –)n ∣ Сl поливинилхлорид РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
- 15. Качественная реакция на алкины с тройной связью в конце цепи: НC≡CH + [Ag(NH3)2]OH → Аg-C≡C-Ag↓ +2NH3
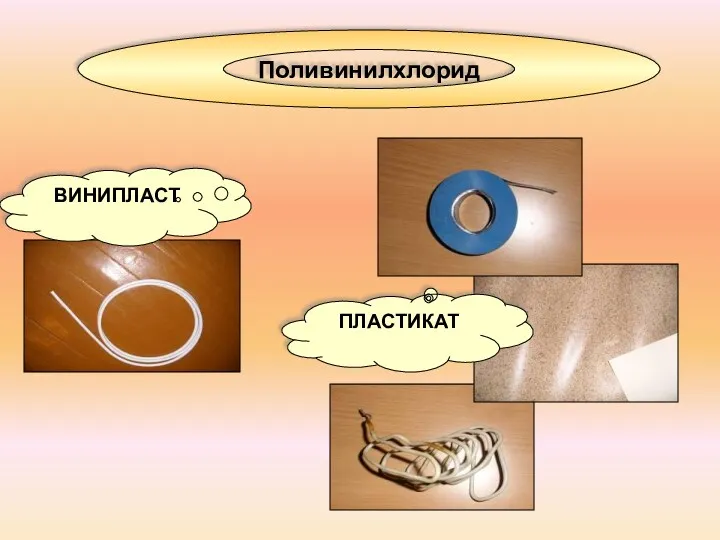
- 17. Поливинилхлорид ПЛАСТИКАТ ВИНИПЛАСТ
- 18. ПОЛИВИНИЛХЛОРИД ПОЛИВИНИЛХЛОРИД Панели ПВХ. Трубы из ПВХ
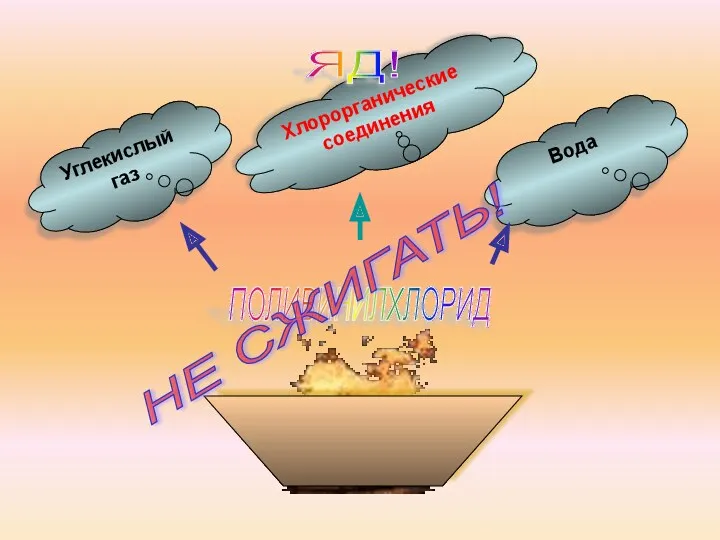
- 19. ПОЛИВИНИЛХЛОРИД Углекислый газ Хлорорганические соединения Вода ЯД! НЕ СЖИГАТЬ!
- 20. Применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный
- 21. СИНТЕТИЧЕСКИЙ КАУЧУК Синтетический каучук Шины из синтетического каучука Материал синтетический каучук
- 22. Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с
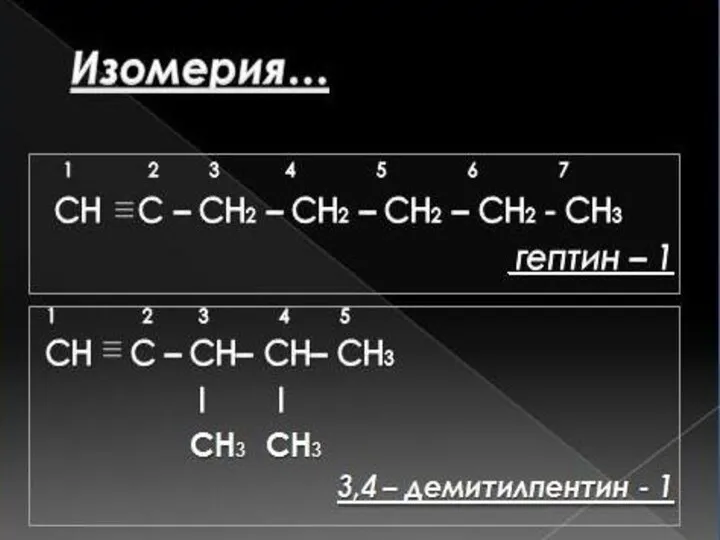
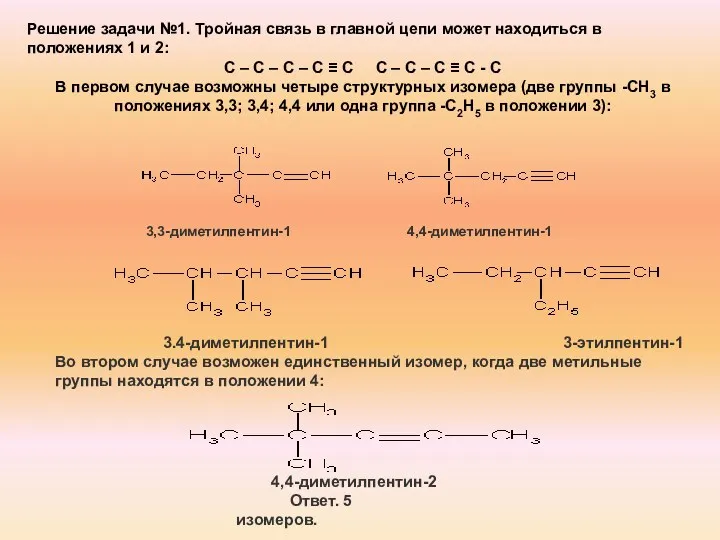
- 23. Задача 1. Напишите структурные формулы изомерных ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти
- 24. 3,3-диметилпентин-1 4,4-диметилпентин-1 3.4-диметилпентин-1 3-этилпентин-1 Во втором случае возможен единственный изомер, когда две метильные группы находятся в
- 25. Решение задачи №2. Ацетилен поглощается бромной водой: НC ≡ СH + 2Вr2 → НСВr2 -СНВr2 .
- 27. Скачать презентацию












 Предмет, цели и задачи товароведения
Предмет, цели и задачи товароведения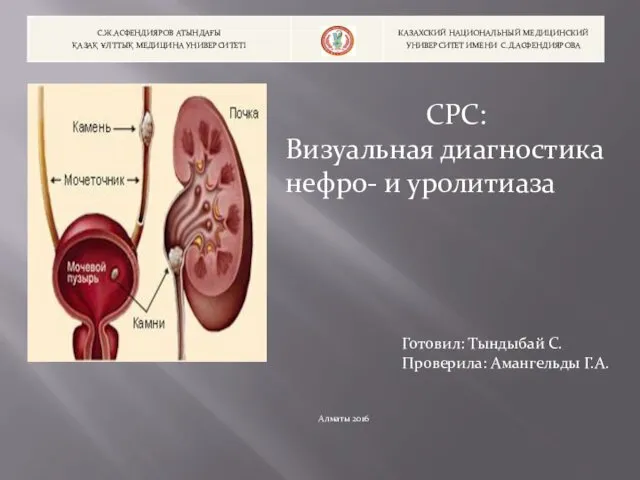 Визуальная диагностика нефро- и уролитиаза
Визуальная диагностика нефро- и уролитиаза Электроснабжение. Понятие о системах электроснабжения
Электроснабжение. Понятие о системах электроснабжения проектная деятельность в начальной школе
проектная деятельность в начальной школе Формирование здорового образа жизни младших школьников на уроках и во внеурочное время
Формирование здорового образа жизни младших школьников на уроках и во внеурочное время Западная Европа в V – X вв
Западная Европа в V – X вв Наблюдение за горящей свечей
Наблюдение за горящей свечей Издержки производства
Издержки производства Презентация о Сергие Радонежском
Презентация о Сергие Радонежском Презентация к уроку технологии Грибы
Презентация к уроку технологии Грибы Древний мир истории Казахстана. Каменный период
Древний мир истории Казахстана. Каменный период Презентация к классному часу Наш герой! Презентация предназначена для учащихся начальных классов, способствующая расширению кругозора и общему развитию детей. Человек и космос. Ю.А.Гагарин.
Презентация к классному часу Наш герой! Презентация предназначена для учащихся начальных классов, способствующая расширению кругозора и общему развитию детей. Человек и космос. Ю.А.Гагарин. 20230816_prezentatsiya_istoriya_raketostroeniya
20230816_prezentatsiya_istoriya_raketostroeniya Персональный компьютер
Персональный компьютер Диагностика детей по программ дополнительного образования художественно-эстетической направленности
Диагностика детей по программ дополнительного образования художественно-эстетической направленности Обобщение по теме Гидросфера
Обобщение по теме Гидросфера Книги, которые я выбираю
Книги, которые я выбираю Музыкальные формы
Музыкальные формы Парад на Красной площади 7 ноября 1941 года
Парад на Красной площади 7 ноября 1941 года Дедушка
Дедушка Образ героя Отечества в портретной живописи
Образ героя Отечества в портретной живописи Жалған круп
Жалған круп Francja
Francja Prezentatsia_Vitaliy
Prezentatsia_Vitaliy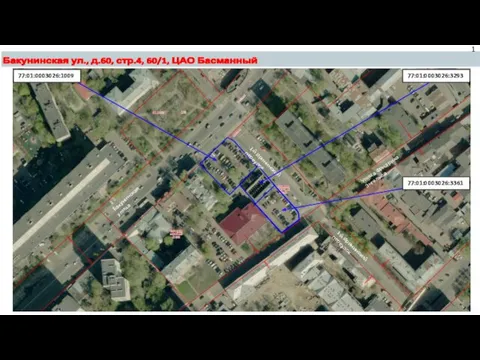 Генеральный план. Бакунинская ул.,д. 60, стр 4, 60/1, ЦАО Бесманный
Генеральный план. Бакунинская ул.,д. 60, стр 4, 60/1, ЦАО Бесманный Жұқпалы аурулардың эпидемиологиялық жіктелуі
Жұқпалы аурулардың эпидемиологиялық жіктелуі Водный транспорт. Морской и речной транспорт
Водный транспорт. Морской и речной транспорт Технология конструкционных материалов в машиностроении
Технология конструкционных материалов в машиностроении