Содержание
- 2. СООТНЕСИТЕ: Формулы: I) СН3 – СН2 – NH – CH II) C6H5 – NH2 III) CH3
- 3. В молекуле амина влияние радикала С6Н5 на группу NH2 проявляется в том, что: 1. повышается электронная
- 4. Тема урока: Белки – основа органической жизни. «Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
- 5. Содержание белка в некоторых тканях (после обезвоживания органа): Мышцы – 80%; Почки – 72%; Кожа –
- 6. В белке следующие химические элементы: С, Н, О, N, S, P, Fe. Массовая доля элементов: С
- 7. Белки – высокомолекулярные природные соединения (биополимеры), состоящие из остатков аминокислот, которые соединены пептидной связью. В природе
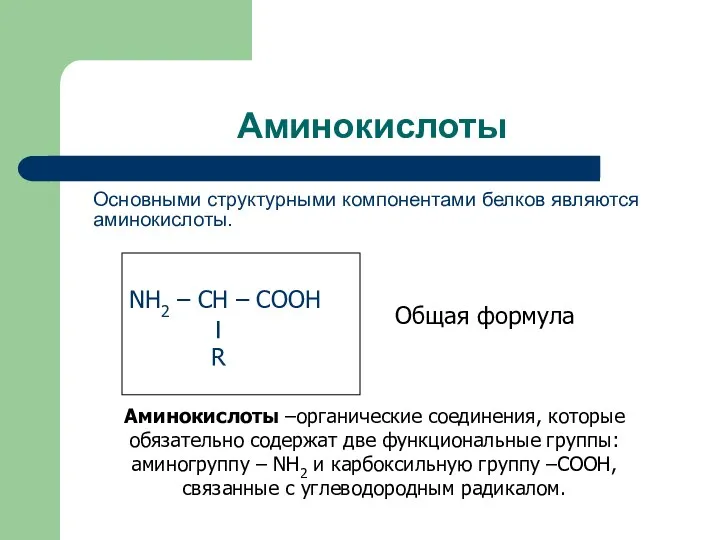
- 8. Аминокислоты Основными структурными компонентами белков являются аминокислоты. Аминокислоты –органические соединения, которые обязательно содержат две функциональные группы:
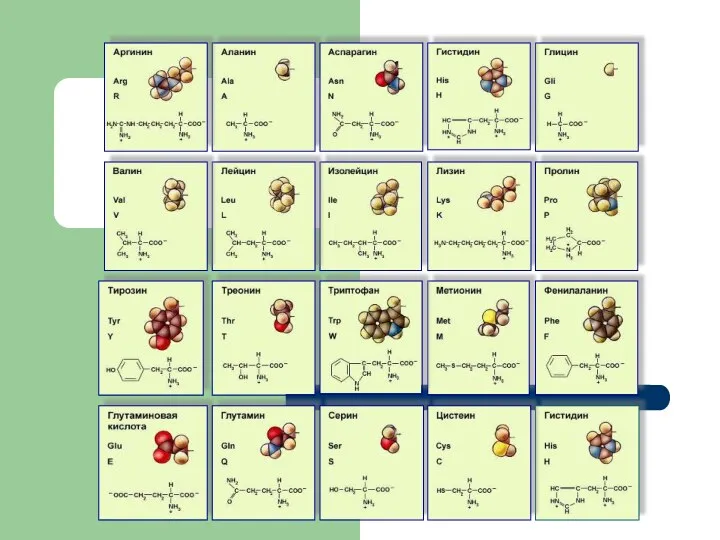
- 10. АМИНОКИСЛОТЫ Заменимые аминокислоты - они могут синтезироваться в организме 2. Незаменимые - в организме не образуются,
- 11. Образование пептидной связи NH2 – CH2 – COOH + NH2 – CH2 – COOH = NH2
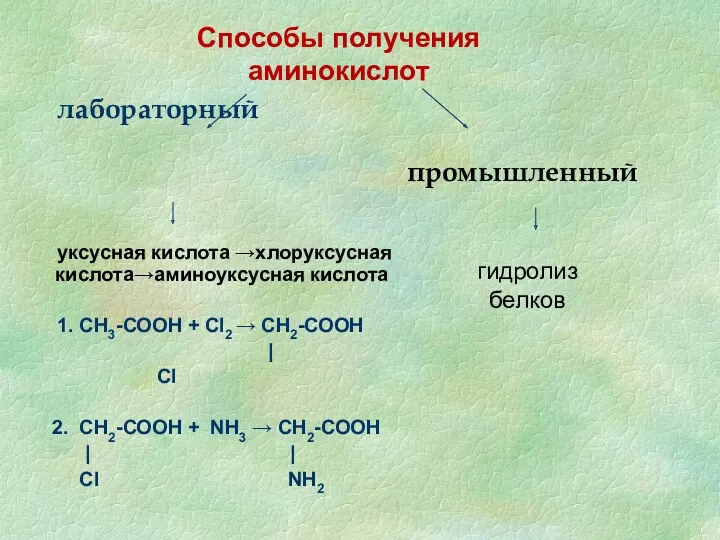
- 12. Способы получения аминокислот лабораторный промышленный гидролиз белков уксусная кислота →хлоруксусная кислота→аминоуксусная кислота 1. СН3-СООН + Сl2
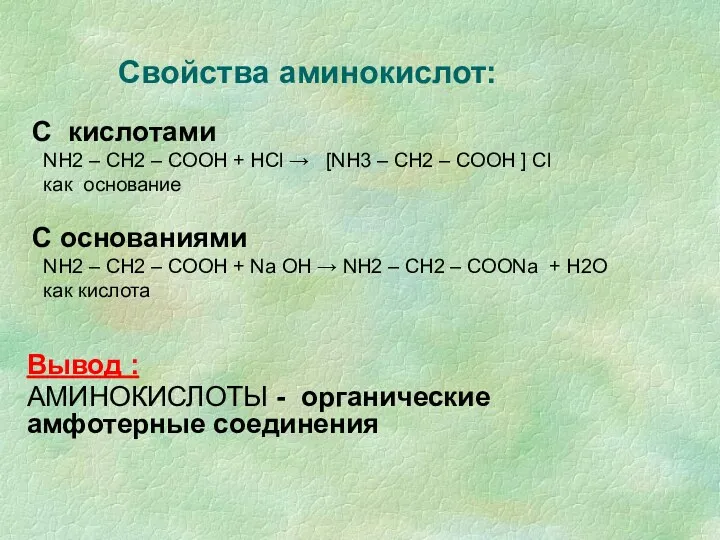
- 13. Свойства аминокислот: С кислотами NH2 – CH2 – COOH + НСl → [NH3 – CH2 –
- 14. Состав и классификация белков Протеины - состоят только из аминокислот. Протеиды – содержат небелковую часть. Сложные
- 15. СТРУКТУРА БЕЛКОВОЙ МОЛЕКУЛЫ 1. Первичная 2. Вторичная 3. Третичная 4. Четвертичная
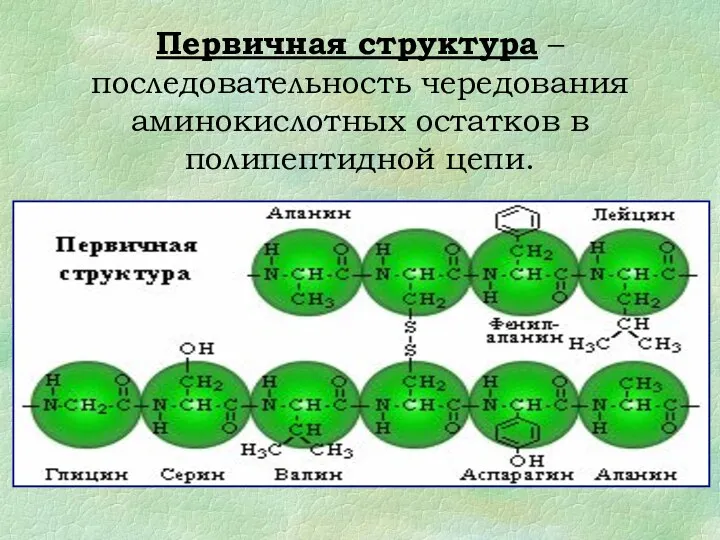
- 16. Первичная структура – последовательность чередования аминокислотных остатков в полипептидной цепи.
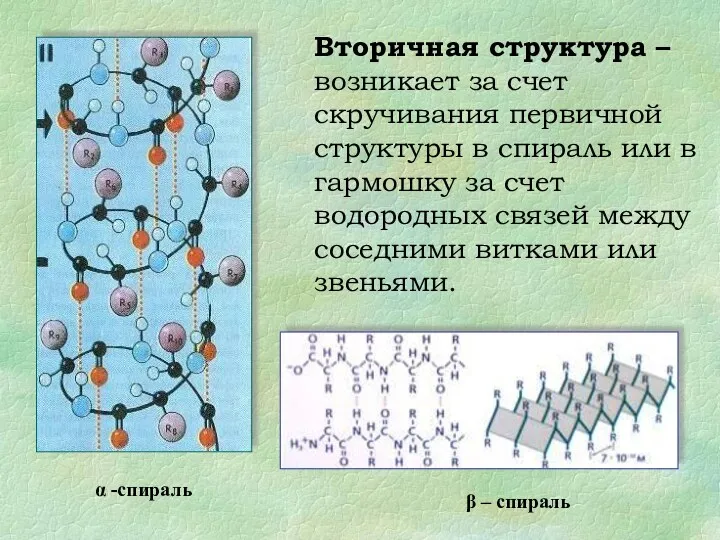
- 17. Вторичная структура – возникает за счет скручивания первичной структуры в спираль или в гармошку за счет
- 18. Третичная структура – трехмерная конфигурация, которую принимает в пространстве закрученная спираль. Образуется за счет гидрофобных связей
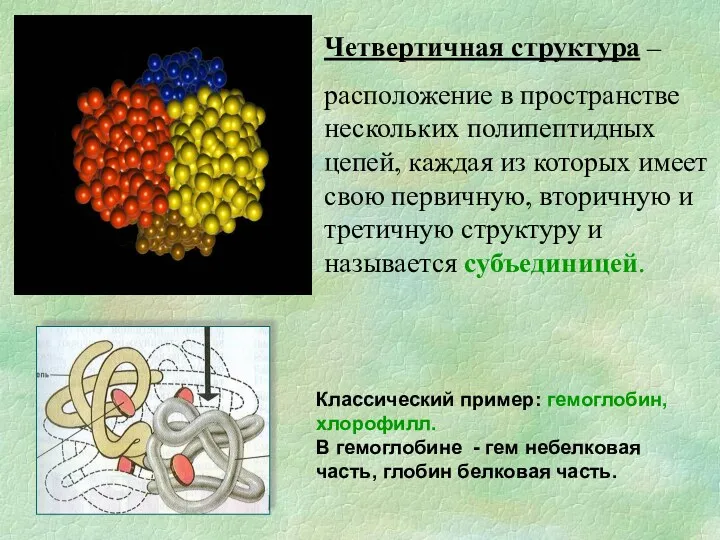
- 19. Четвертичная структура – расположение в пространстве нескольких полипептидных цепей, каждая из которых имеет свою первичную, вторичную
- 20. Свойства белков Белки могут быть как растворимы, так и нерастворимы в воде в зависимости от их
- 21. Свойства белков Водорастворимые белки образуют коллоидные растворы
- 22. Свойства белков При обработке хлоридом натрия белки высаливаются из раствора. Этот процесс обратим.
- 23. Свойства белков Кислоты, щелочи и высокая температура разрушают структуру белков и приводят к их денатурации. Белки
- 24. Свойства белков Поместите кусочек прессованного творога в пробирку и добавьте несколько капель азотной кислоты. Осторожно нагрейте.
- 25. Свойства белков. Налейте в пробирку 2 мл яичного белка . Добавьте такой же объем концентрированного раствора
- 26. Функции белков Строительная (пластическая) – белки участвуют в образовании оболочки клетки, органоидов и мембран клетки. Каталитическая
- 28. Скачать презентацию

















 Статистическая радиофизика. Модели случайных процессов. (Тема 4)
Статистическая радиофизика. Модели случайных процессов. (Тема 4) Выпускники
Выпускники Библия, правда или ложь
Библия, правда или ложь Энергетические характеристики агрегатов и ГЭС
Энергетические характеристики агрегатов и ГЭС Задания командам. Треугольники. (7 класс)
Задания командам. Треугольники. (7 класс) Принципиальная пневматическая схема вагона ЛМ - 68М
Принципиальная пневматическая схема вагона ЛМ - 68М Анализ имиджа компании на примере турагенства САКВОЯЖ-ТУР
Анализ имиджа компании на примере турагенства САКВОЯЖ-ТУР Гербарий сказочных растений
Гербарий сказочных растений 20200102_splav_po_reke_kurba3
20200102_splav_po_reke_kurba3 Система менеджмента качества в аптечных организациях
Система менеджмента качества в аптечных организациях “Екі жұлдыз, бір тілек” стратегиясы
“Екі жұлдыз, бір тілек” стратегиясы Prezentatsia_Pashnin
Prezentatsia_Pashnin Розничная торговая сеть. Технологические операции в магазине
Розничная торговая сеть. Технологические операции в магазине ШАБЛОН ДЛЯ ПРЕЗ
ШАБЛОН ДЛЯ ПРЕЗ Решение задач по химическим уравнениям
Решение задач по химическим уравнениям Обдирочно-зачистное отделение цеха. Проект электроснабжения
Обдирочно-зачистное отделение цеха. Проект электроснабжения Рококо
Рококо Расчетные модели конструкций, зданий и сооружений
Расчетные модели конструкций, зданий и сооружений Упражнение для глаз. Состроили глазки
Упражнение для глаз. Состроили глазки Цифровая грамотность студентов МОСГУ
Цифровая грамотность студентов МОСГУ Кратковременные механические свойства титановых сплавов. Лекция 3
Кратковременные механические свойства титановых сплавов. Лекция 3 Ремонт силових трансформаторів
Ремонт силових трансформаторів презентация к уроку Деление слог на слоги
презентация к уроку Деление слог на слоги Конспект образовательной деятельности по экологии в средней группе с использованием ИКТ на тему: Берегите лес
Конспект образовательной деятельности по экологии в средней группе с использованием ИКТ на тему: Берегите лес Мастер-класс по созданию подсвечника из кофейных зерен
Мастер-класс по созданию подсвечника из кофейных зерен Органы чувств
Органы чувств Общие положения реконструкции городского жилого фонда
Общие положения реконструкции городского жилого фонда Правила пожарной безопасности в плакатах.
Правила пожарной безопасности в плакатах.