Слайд 2

Цель урока:
рассмотреть гомологический ряд предельных УВ, строение молекул алканов.
ознакомить учащихся с изомерией предельных УВ.
физическими свойствами и основными способами получения.
Слайд 3

уравнения химических реакции горения
CH4 +2O2 → 2H2O + CO2↑
2C2H6 +7O2
→ 6H2O + 4CO2↑
C3H8 +5O2 → 4H2O + 3CO2↑
2C4H10 +13O2 → 10H2O + 8CO2↑
C5H12 +8O2 → 6H2O + 5CO2↑
2C6H14 +19O2 → 14H2O + 12CO2↑
Слайд 4

Определение алканов
Это предельные углеводороды, в молекулах которых все атомы связаны одинарными
связами
Слайд 5

Общая формула алканов
Сn H2n+2
Слайд 6

Гомологический ряд
СН4 метан С2Н6 этан
С3Н8 пропан С4Н10 бутан
С5Н12 пентан С6Н14 гексан
С7Н16
гептан С8Н18 октан
С9Н20 нонан С10Н22 декан
Слайд 7

Название радикалов
CH3 метил
C2H5 этил
C3H7 пропил
C4H9 бутил
C5H11 пентил
C6H13 гексил
Слайд 8

Физические свойства
С1 – С4 – газы,
С5 –С15 – жидкости,
С16 -
∞ -твердые вещества
Газы и твердые алканы запаха не имеют, жидкие имеют бензиновый запах. Легче воды. Плохо растворимы в воде
Слайд 9

Строение алканов
Молекула первого члена гомологического ряда алканов – метан имеет тетраэдрическое
строение.
Все атомы углерода в молекулах алканов находятся в состоянии sp3 гибридизации Угол между связами составляет109 28 длина связи С — С в предельных углеводородах 0,154 нм.
Слайд 10
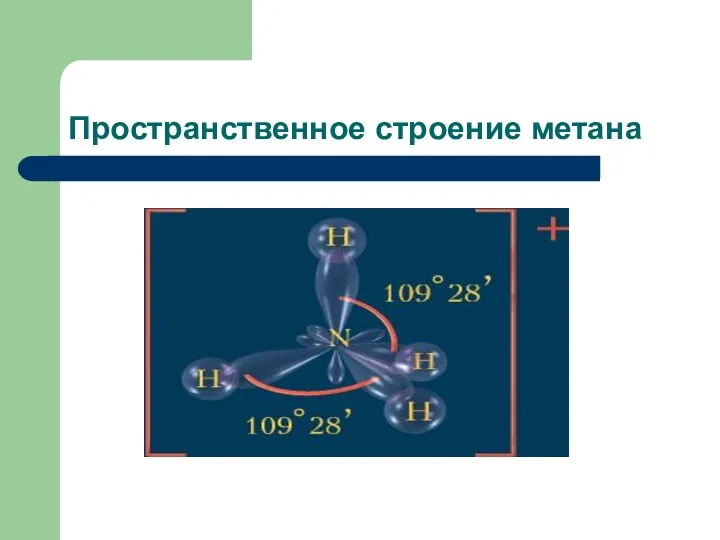
Пространственное строение метана
Слайд 11

Виды изомерии
Структурная
Углеродного скелета
Положения кратной связи
Положения функциональной группы
Межклассовая
Слайд 12

Алгоритм составления названия алканов
1.В структурной формуле выбирают самую длинную цепь
атомов углерода (главную цепь)
2.Атомы углерода главной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
3.В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода ,с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов (два, три, четыре и т. д) то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
4.Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что и в главной цепи.
Слайд 13
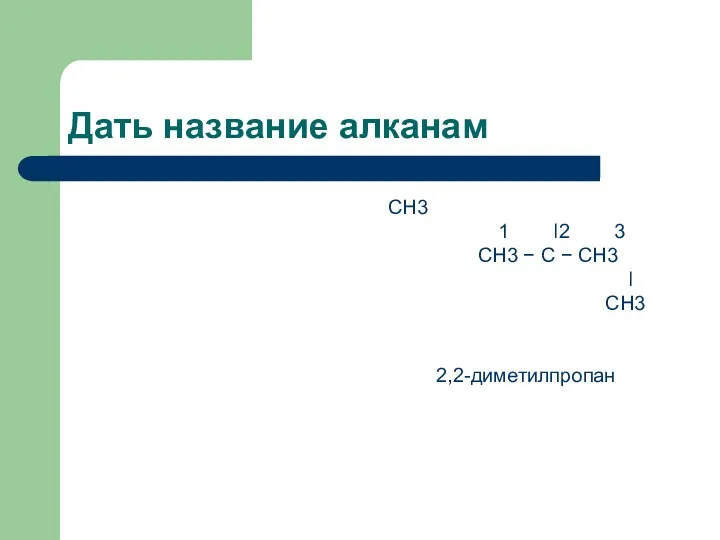
Дать название алканам
CH3
1 ǀ2 3
CH3 − C
− CH3
ǀ
CH3
2,2-диметилпропан
Слайд 14
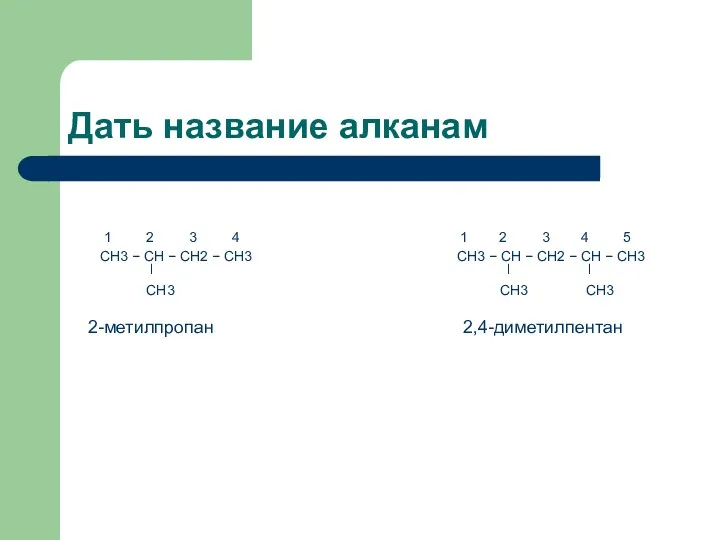
Дать название алканам
1 2 3 4 1 2 3 4
5
CH3 − CH − CH2 − CH3 CH3 − CH − CH2 − CH − CH3
ǀ ǀ ǀ
CH3 CH3 CH3
2-метилпропан 2,4-диметилпентан
Слайд 15
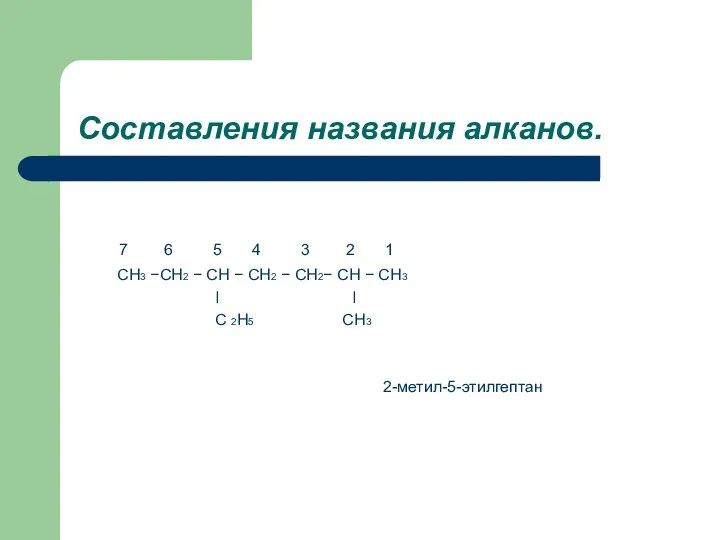
Составления названия алканов.
7 6 5 4 3 2 1
CH3 −CH2 − CH − CH2 − CH2− CH − CH3
ǀ ǀ
C 2H5 CH3
2-метил-5-этилгептан
Слайд 16

Получение алканов.
Получение метана
1.В п р о м ы ш
л е н н о с т и:
а)из природного газа
б)синтез из оксида углерода (II) и водорода
Ni,300˚C
CO + 3H2 → CH4 ↑ +H2O
Слайд 17

Получение метана
В л а б о р а т о
р и и
а)гидролиз карбида алюминия
Al4C3 +12H2O → 3CH4 ↑ +4Al(OH)3
б )сплавление солей уксусной кислоты со щелочами
CH3COONa +NaOH (т) → CH4 ↑ +Na2CO3
Слайд 18

Получение гомологов метана.
В п р о м ы ш л
е н н о с т и
а) из природного сырья (нефть, газ, горный воск)
б) синтез из оксида углерода (II) и водорода
Слайд 19

Получение гомологов метана.
В л а б о р а т о
р и и
а)каталитическое гидрирование непредельных углеводородов (алкенов,алкинов)
Pt
CnH2n + H2 → CnH2n+2
Ni,150˚C
CnH2n-2 + 2H2 → CnH2n+2
б) взаимодействие галогеноалканов с натрием (реакция Вюрца)
2R−Br +Na → R−R + 2NaBr
2CH3Br + Na → CH3 − CH3 +2NaBr


















 Ремонт тормозного оборудования электровоза ВЛ-10
Ремонт тормозного оборудования электровоза ВЛ-10 Особенности конструирования рабочей программы по биологии
Особенности конструирования рабочей программы по биологии Крым. Севастополь
Крым. Севастополь Паянок_Басюк_2022 (2)
Паянок_Басюк_2022 (2) Презентация Названы именем Д.И.Менделеева
Презентация Названы именем Д.И.Менделеева Буллинг. Информация для подростков
Буллинг. Информация для подростков Ancient Aztecs
Ancient Aztecs Металлургия России
Металлургия России Патохарактерологические и социально-психологические факторы формирования агрессивного и делинквентного поведения у подростков
Патохарактерологические и социально-психологические факторы формирования агрессивного и делинквентного поведения у подростков Свойства. Алгебра 8 класс
Свойства. Алгебра 8 класс Перевозка грузов в контейнерах, автопоездах и контрейлерах
Перевозка грузов в контейнерах, автопоездах и контрейлерах Любимой жене в день рождения
Любимой жене в день рождения Родовые понятия и методологические основания социологии Эмиля Дюркгейма в цитатах
Родовые понятия и методологические основания социологии Эмиля Дюркгейма в цитатах Биологические особенности пушных зверей и кроликов
Биологические особенности пушных зверей и кроликов Рисуем божью коровку (1 класс)
Рисуем божью коровку (1 класс) Общие сведения о Божественной Литургии (Лекция 4)
Общие сведения о Божественной Литургии (Лекция 4) ЧС. Основные понятия и классификация
ЧС. Основные понятия и классификация Дистанционный урок. Пластинчатый способ лепки.
Дистанционный урок. Пластинчатый способ лепки. Лекция 7. Права и обязанности педагога
Лекция 7. Права и обязанности педагога сценарий праздника масленицы с презентацией
сценарий праздника масленицы с презентацией Функциональные компоненты ОС автономного компьютера
Функциональные компоненты ОС автономного компьютера Типы химических реакций
Типы химических реакций Презентация. Логопедическое царство, игровое государство
Презентация. Логопедическое царство, игровое государство ПЗ 1
ПЗ 1 Администрация Щёлковского муниципального района Московской области. Подготовка к осенне-зимнему периоду 2018-2019 года
Администрация Щёлковского муниципального района Московской области. Подготовка к осенне-зимнему периоду 2018-2019 года Презентация материала к собранию для родителей будущих первоклассников о системе Занкова
Презентация материала к собранию для родителей будущих первоклассников о системе Занкова Реки России
Реки России Внутренняя память. Основная, внешняя и архивная память
Внутренняя память. Основная, внешняя и архивная память