Содержание
- 2. Содержание Давыдова Н.Б., учитель химии МБОУ "Вадская СОШ", Вад Подготовка к усвоению нового материала. Изучение нового
- 3. Подготовка к усвоению нового материала 1807 г. английский физик и химик Гемфри Дэви с помощью электричества
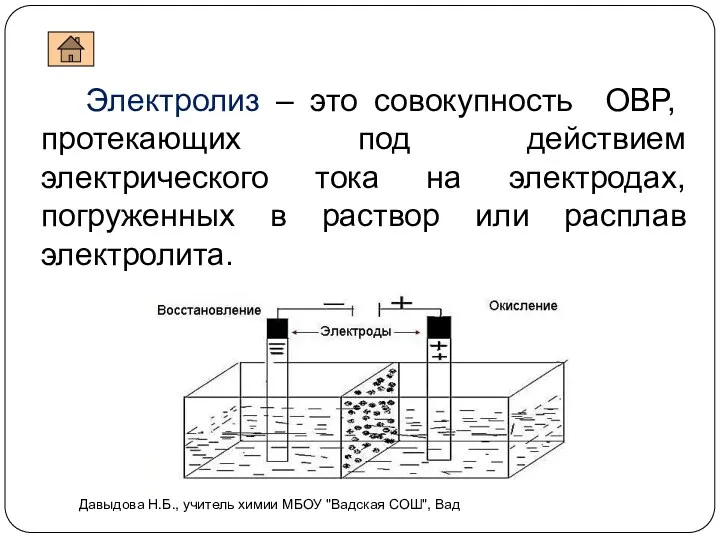
- 4. Электролиз – это совокупность ОВР, протекающих под действием электрического тока на электродах, погруженных в раствор или
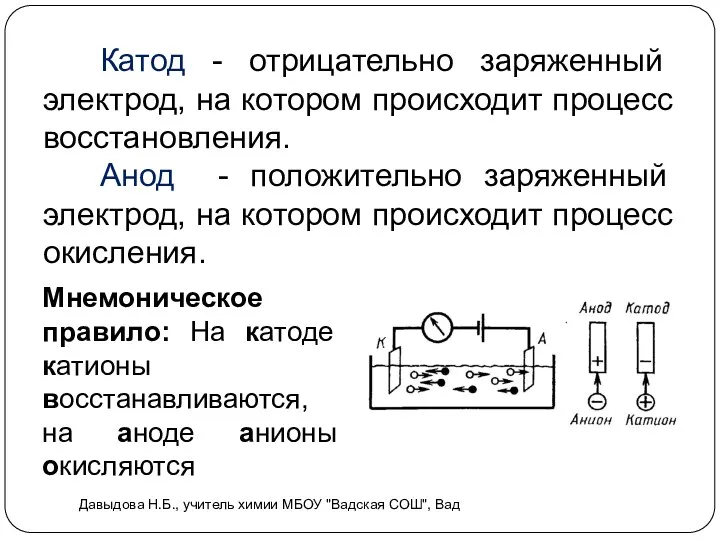
- 5. Катод - отрицательно заряженный электрод, на котором происходит процесс восстановления. Анод - положительно заряженный электрод, на
- 6. Виды анодов: 1. Инертные аноды (нерастворимые, пассивные): материал анода не окисляется, окисляются ионы электролита (платина, графит).
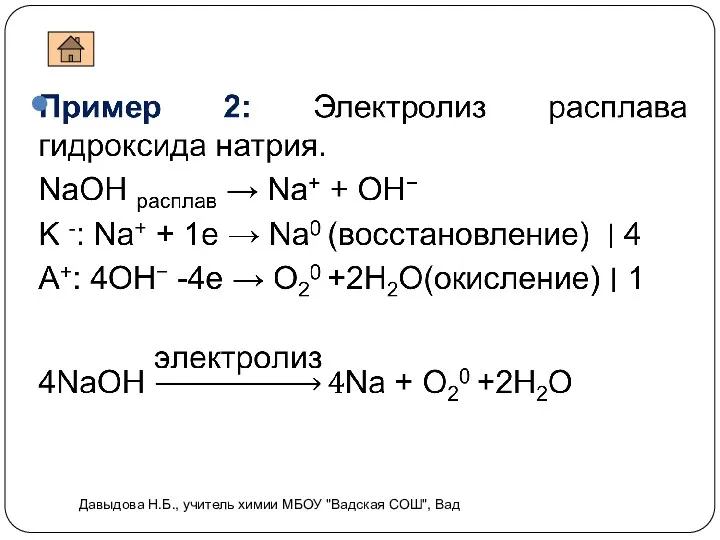
- 7. Электролиз расплавов Давыдова Н.Б., учитель химии МБОУ "Вадская СОШ", Вад
- 8. Давыдова Н.Б., учитель химии МБОУ "Вадская СОШ", Вад
- 9. На катоде: От Li+ до Al 3+ (включительно) восстанавливаются молекулы воды или катионы H+: 2H2O+2e →H2↑+2OH−
- 10. Катодные процессы: От Al 3+ до Н2 восстанавливаются металл и молекулы воды (катионы H+): Men+ +
- 11. Анодные процессы: I. Нерастворимый анод (инертный) Рt, C Окисляются: 1. Анионы бескислородных кислот: I-, Br-, S2-,
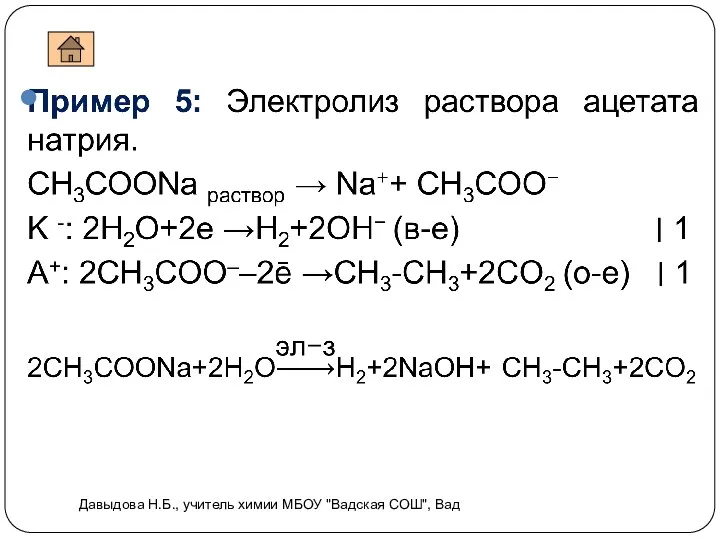
- 12. Видеоопыт . Электролиз раствора иодида калия Пример 3: Электролиз раствора иодида калия. Давыдова Н.Б., учитель химии
- 13. Давыдова Н.Б., учитель химии МБОУ "Вадская СОШ", Вад
- 14. Давыдова Н.Б., учитель химии МБОУ "Вадская СОШ", Вад
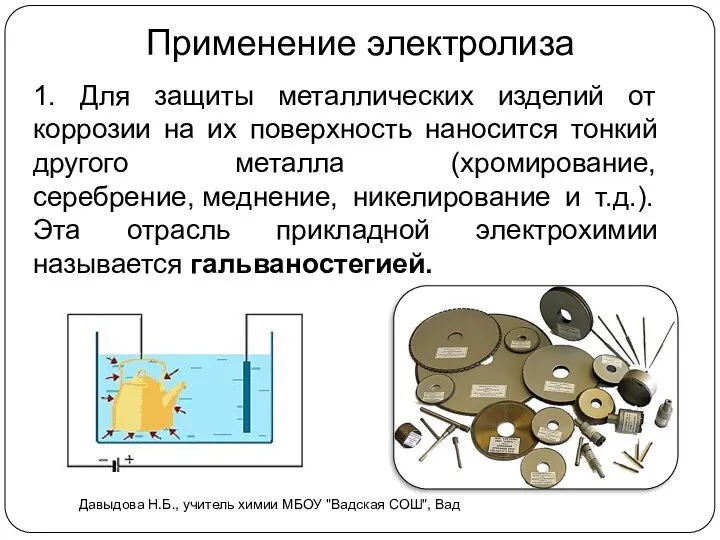
- 15. Применение электролиза 1. Для защиты металлических изделий от коррозии на их поверхность наносится тонкий другого металла
- 16. 2. Гальванопластика - получение точных металлических копий с предметов. С помощью гальванопластики изготавливают клише для печатания
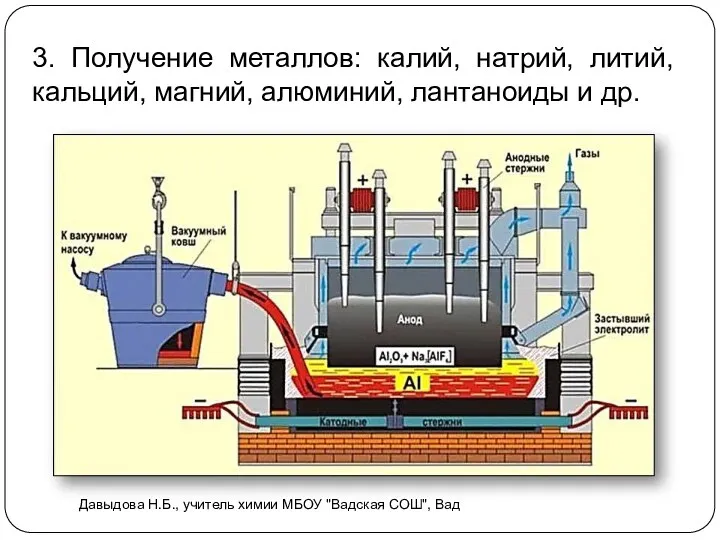
- 17. 3. Получение металлов: калий, натрий, литий, кальций, магний, алюминий, лантаноиды и др. Давыдова Н.Б., учитель химии
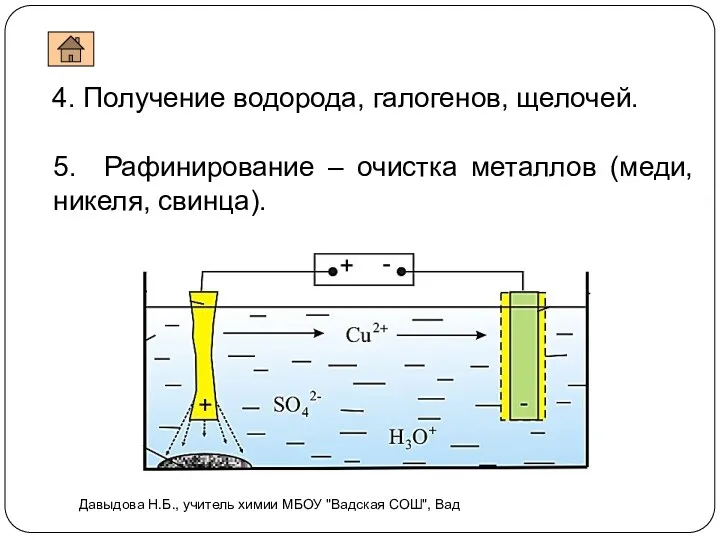
- 18. 4. Получение водорода, галогенов, щелочей. 5. Рафинирование – очистка металлов (меди, никеля, свинца). Давыдова Н.Б., учитель
- 19. Закрепление и применение полученных знаний Базовый уровень сложности 1. При электролизе AgNO3 на катоде выделяется (-ются):
- 20. Закрепление и применение полученных знаний Повышенный уровень сложности 4. Установите соответствие между формулой вещества и продуктами
- 21. Закрепление и применение полученных знаний Повышенный уровень сложности 5. Установите соответствие между формулой соли и продуктом,
- 22. Рефлексия: 1. Что нового вы узнали сегодня на уроке? 2. Что запомнилось? 3. Что понравилось, а
- 23. Домашнее задание: Учебник: Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н.; под ред. Н. Е. Кузнецовой. Химия: профильный
- 24. 1. Кузнецова Н.Е., Литвинова Т.Н., Левкин А.Н.; под ред. Н. Е. Кузнецовой. Химия: профильный уровень. Ч.1
- 26. Скачать презентацию
















 Титульные листы
Титульные листы Модель Окамура-Хата
Модель Окамура-Хата Кто нас защищает. МЧС России
Кто нас защищает. МЧС России Мешочек для новогоднего подарка
Мешочек для новогоднего подарка Итоговое родительское собрание в 4Б классе.2012 -2013 уч.год.Презентация.
Итоговое родительское собрание в 4Б классе.2012 -2013 уч.год.Презентация. Схемы электровоза 2ЭС4К
Схемы электровоза 2ЭС4К Лучшие фотографии вторая половина 20 века
Лучшие фотографии вторая половина 20 века Применение распределительного свойства умножения
Применение распределительного свойства умножения Презентация к уроку труда Сердце, полное роз
Презентация к уроку труда Сердце, полное роз Наказание и поощрение в воспитании ребёнка
Наказание и поощрение в воспитании ребёнка Карен Хорни: социокультурная теория личности
Карен Хорни: социокультурная теория личности Где живут слоны?
Где живут слоны? Зеленый уголок. Ландшафтный дизайн
Зеленый уголок. Ландшафтный дизайн Использование дождевых и талых вод в водоснабжении промышленных объектов
Использование дождевых и талых вод в водоснабжении промышленных объектов 20231031_problema_antigeroya_v_literature._urok_-lektsiya
20231031_problema_antigeroya_v_literature._urok_-lektsiya Бартоломео Франческо Растрелли (Варфоломей Варфоломеевич Растрелли) 1700 - 1771
Бартоломео Франческо Растрелли (Варфоломей Варфоломеевич Растрелли) 1700 - 1771 Заболевания носа и придаточных пазух. Методы исследования. Ожоги наружного носа
Заболевания носа и придаточных пазух. Методы исследования. Ожоги наружного носа Правительство Самарской области
Правительство Самарской области Цифровая схемотехника. Цифровые сигналы. 1
Цифровая схемотехника. Цифровые сигналы. 1 Дворцовые перевороты
Дворцовые перевороты Социальные гарантии для сотрудников уголовно-исполнительной системы
Социальные гарантии для сотрудников уголовно-исполнительной системы Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли Терроризм. Основные типы терроризма
Терроризм. Основные типы терроризма Абсолютизм в Западной Европе. Тридцатилетняя война 1618-1648года
Абсолютизм в Западной Европе. Тридцатилетняя война 1618-1648года День Земли
День Земли Анатомия и физиология мужской репродуктивной системы
Анатомия и физиология мужской репродуктивной системы Снятие мерок
Снятие мерок В мире книг Альберта Лиханова
В мире книг Альберта Лиханова